Quelles sont les bases de la spectroscopie vibrationnelle ?
Interprétation des spectres IR
La première étape utile pour l'interprétation des spectres est l'analyse de son apparence générale :
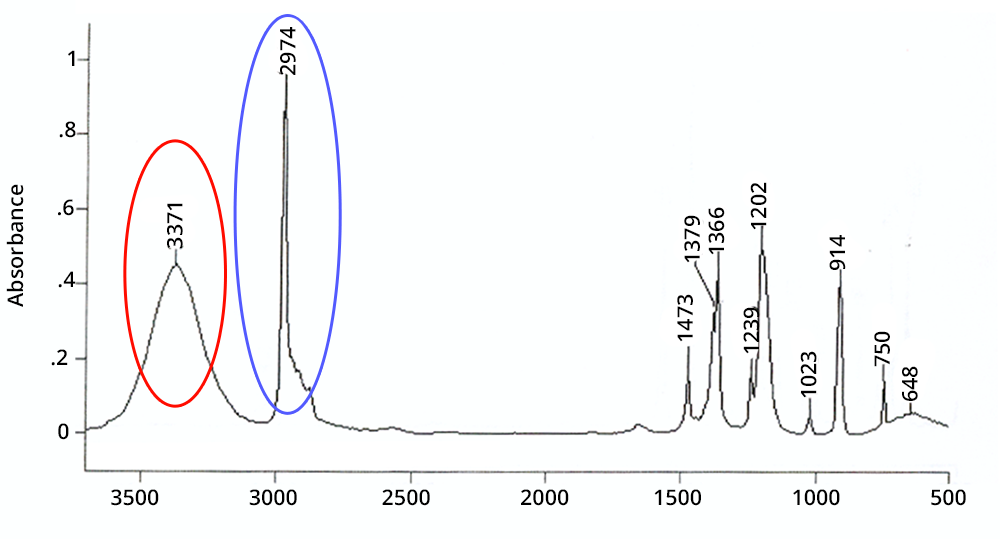
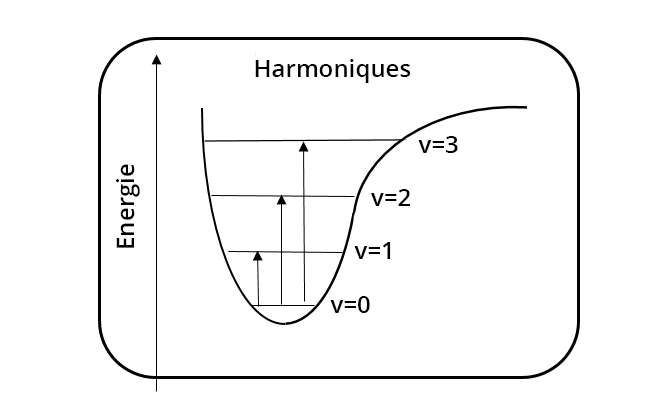
Un pic est large s'il correspond à une fonction chimique impliquée dans des liaisons hydrogène ou s'il s'agit d'une combinaison ou harmonique - dans ce dernier cas son intensité est très faible
Un pic est intense en IR si la fonction chimique à laquelle il correspond est présente plusieurs fois dans la molécule (additivité de la loi de Beer-Lambert) ou si les atomes impliqués possèdent une grande différence d'électronégativité (ex : CO, OH)
Cliquer sur chaque zone entourée pour en savoir plus
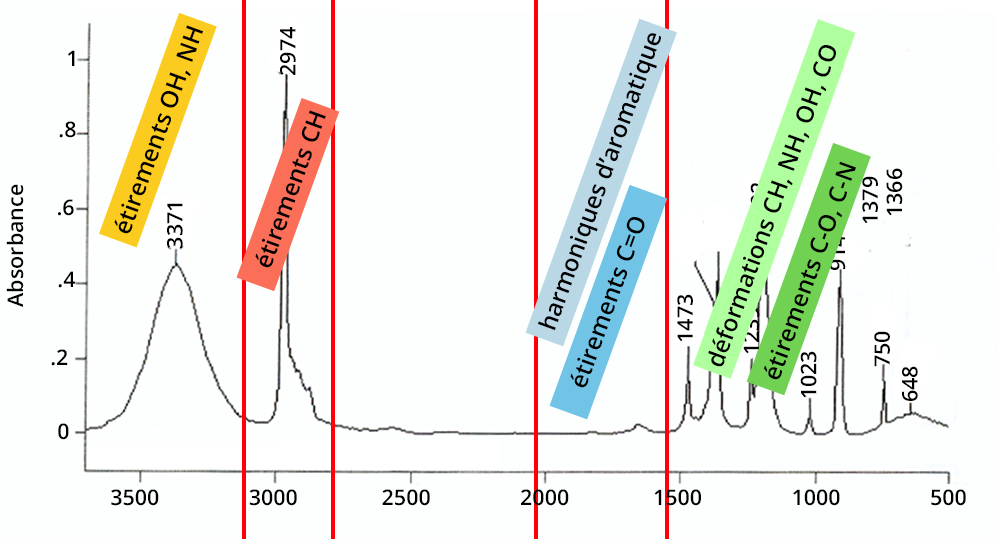
La seconde étape est de comparer la position des vibrations avec les tables d'interprétation existantes.
La position des pics dépend de la force de la liaison entre les deux atomes et de leur masse réduite :

Stratégie : démarrer par les pics aux hauts nombres d'onde et confirmer les étirements par leurs déformations associées.
Cliquer sur chaque zone pour en savoir plus