Principe
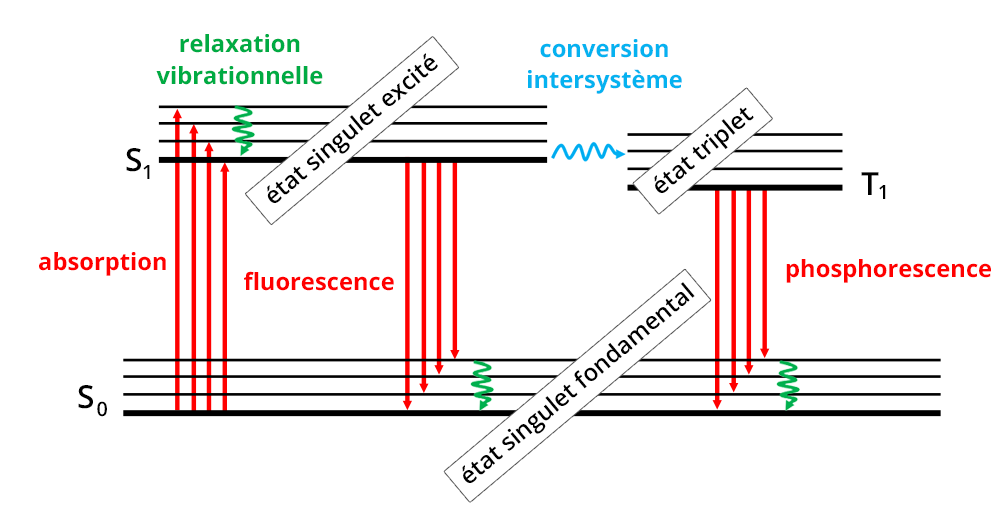
Le phénomène d'absorption repose sur l'interaction entre un rayonnement électromagnétique et les électrons d'une molécule. Lors de l'absorption par l’échantillon d’un faisceau lumineux, les radiations induisent des transitions électroniques, c’est-à-dire le passage d'un électron de valence d'un niveau fondamental vers un niveau excité (Diagramme de Perrin-Jablonski).
L'onde électromagnétique est caractérisée par son énergie ou sa longueur d'après la relation: E = hc/λ
avec :
h = 6,62.10-34 J.s (constante de Planck)
c = 3.108 m/s (vitesse de la lumière)
λ = longueur d'onde (en nm)
Les niveaux électroniques d'une molécule étant quantifiés, la condition pour que l'absorption ait lieu est donnée par la relation : ΔE = Eniveau excité – Eniveau fondamental
C’est-à-dire que l'énergie du rayonnement lumineux doit être supérieure ou égale à la différence d'énergie entre le niveau fondamental et le niveau excité.
L'énergie des orbitales moléculaires est propre à chaque groupement ou fonction chimique, la longueur d’onde d’absorption est donc corrélée à la nature des liaisons chimiques.