Quelles sont les bases de la spectroscopie d'absorption UV-visible ?
Transitions électroniques
Après excitation par une onde électromagnétique, les électrons de valence sont impliqués dans des transitions électroniques. Seulement quatre types de transitions sont permises entre les orbitale σ, π et les doublets non liants n.
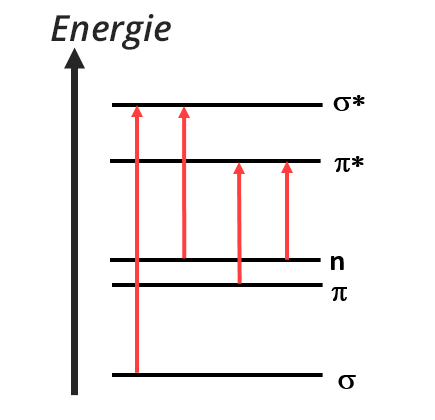
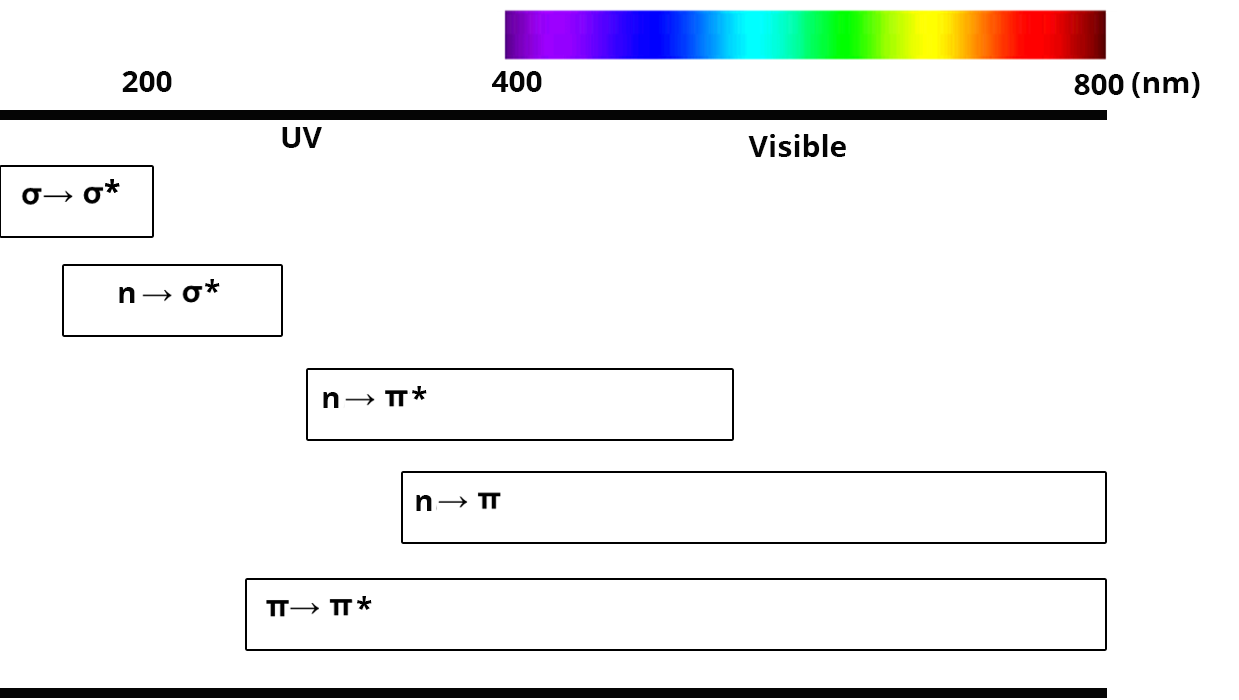
Transition σ → σ*
- n'implique que des liaisons simples (C-H ou C-C par exemple)
- nécessite beaucoup d’énergie, elle se situe donc dans l’UV (
Transition n → σ*
- présente pour des atomes possédant des électrons non liants (N, O, S….)
- nécessite beaucoup d’énergie, elle se situe donc entre 150 et 250 nm
Transition n → π* et n → π
- présentes pour des atomes possédant des électrons non liants et des fonctions insaturées
- il est parfois possible d’observer une transition n → π lorsque le niveau du doublet est inférieur à celui de l’orbitale π
- ces transitions se situent en général dans le domaine de l'UV
Transition π → π* (aromatiques)
- présentes pour des atomes possédant des fonctions insaturées
- se situent dans le domaine UV et visible (200 à 700 nm)