Comment utiliser un pH-mètre ?
Pourquoi mesurer le pH ?
- Préparer un tampon au pH maitrisé nécessaire à la réalisation d’expérience chimique ou biochimique dans des conditions optimales .
- Suivre et orienter une réaction chimique et/ou un procédé de transformation d’un aliment.
Le pH c’est quoi?
Selon Sørensen le pH est défini comme étant le logarithme négatif de la concentration en ions H3O+ , hydronium, issus de la dissociation de molécule:
pH = –log [H3O+]
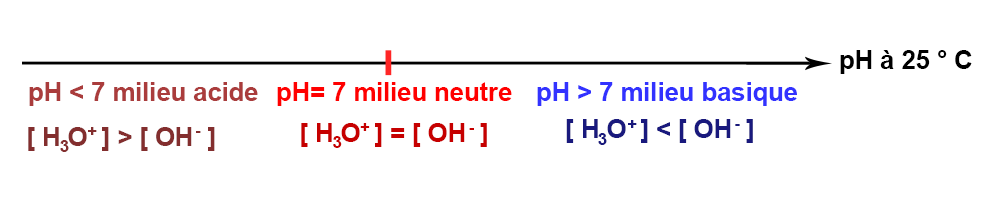
Le pH Neutre c’est quoi?
Les acides et bases ne sont pas seuls à se dissocier pour former des ions hydronium ou hydroxyle, l’eau pure se dissocie elle aussi en formant ces ions :
2 H2O ⇔ H3O+ + OH–
Kw = [H3O+][OH–] = 10–14 mol/L (25 ºC)
Or c’est le cas lorsque la concentration de [H3O+] et [OH–] est de 10–7 mol/L, soit à pH 7.
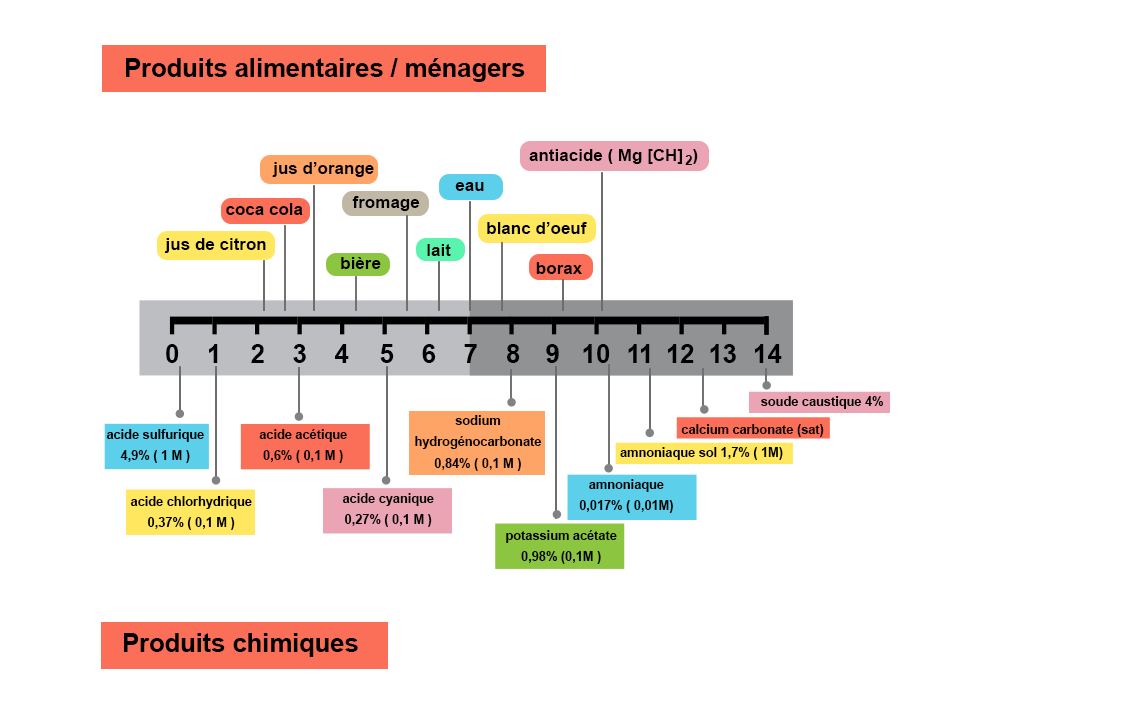
Des ordres de grandeurs de pH