Un pH-mètre c’est quoi?
Pour mesurer le pH on a besoin d’un outil de mesure sensible aux ions hydronium qui déterminent le pH. Il s’agit d’un voltmètre.
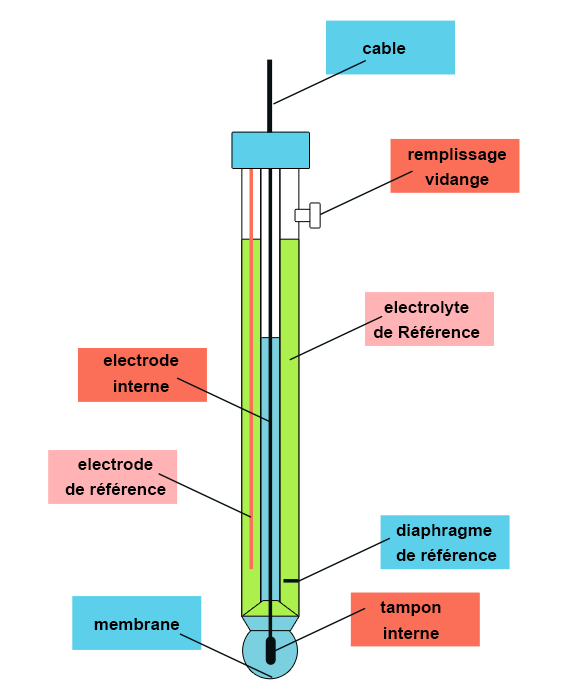
Le principe de la mesure consiste à prendre un capteur avec une membrane en verre sensible aux ions hydronium (électrode pH) et à observer la réaction entre la membrane et l’ échantillon : mesure d’un potentiel.
Ce potentiel est comparé à un potentiel de référence délivré par une électrode insensible au pH, par diffusion d’électrolyte vers l’échantillon au travers d’un diaphragme : électrode de référence (Ag/AgCl).
Le pH d’une solution est alors la différence de potentiel entre les deux électrodes selon l’équation de Nernst :
Pour un usage plus simple, les 2 électrodes sont combinées en une seule électrode.
Le principe de la mesure consiste à prendre un capteur avec une membrane en verre sensible aux ions hydronium (électrode pH) et à observer la réaction entre la membrane et l’ échantillon : mesure d’un potentiel.
Ce potentiel est comparé à un potentiel de référence délivré par une électrode insensible au pH, par diffusion d’électrolyte vers l’échantillon au travers d’un diaphragme : électrode de référence (Ag/AgCl).
Le pH d’une solution est alors la différence de potentiel entre les deux électrodes selon l’équation de Nernst :
E = E0 + 2.3RT / nF * log [H3O+]
E = potentiel mesuré
E0 = constante
R = constante des gaz parfaits
T = température en degrés Kelvin
n = charge ionique
F = constante de Faraday
E0 = constante
R = constante des gaz parfaits
T = température en degrés Kelvin
n = charge ionique
F = constante de Faraday
Pour un usage plus simple, les 2 électrodes sont combinées en une seule électrode.