Le titrage en pratique
Le titrant est placé dans une burette graduée de précision surmontant un bécher contenant un volume précis Vtitré du soluté titré dont on souhaite déterminer la concentration Ctitré.
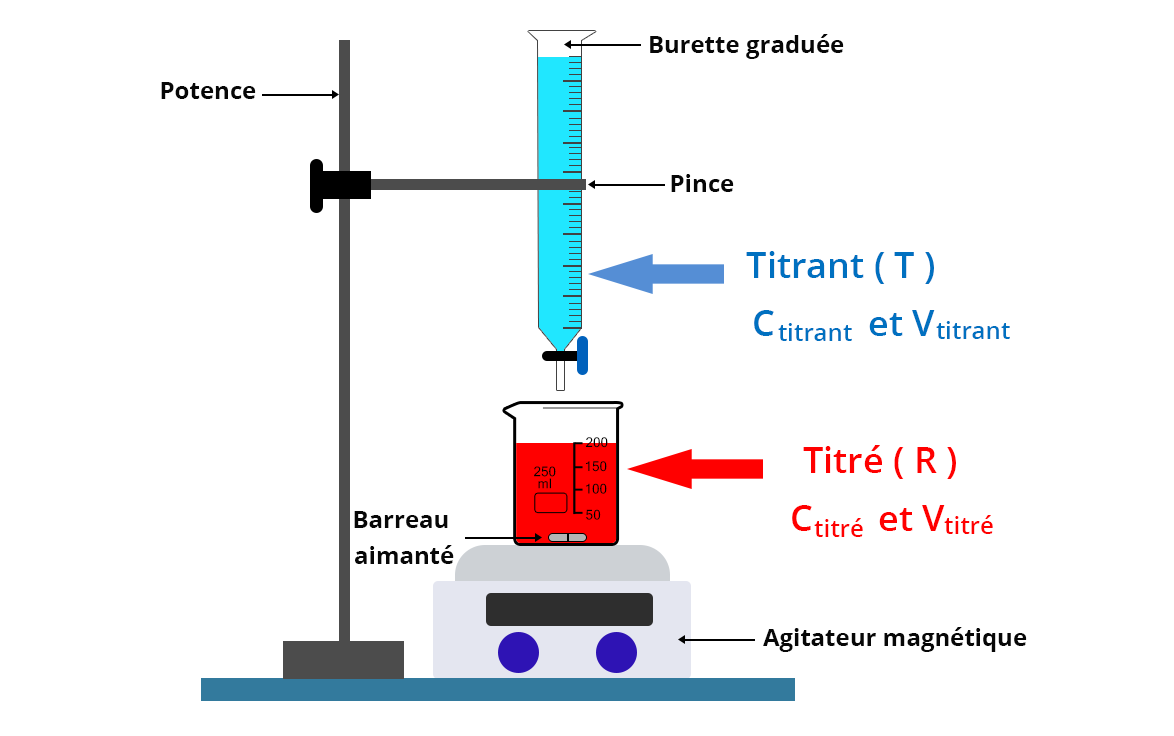
Dans le cas d’un titrage colorimétrique, un erlenmeyer peut également être utilisé à la place d’un bécher pour éviter les projections. En revanche, dès lors que ce titrage colorimétrique est accompagné d’un suivi pH-métrique, conductimétrique ou potentiométrique, il est nécessaire de prendre un bécher afin que les électrodes et/ou la cellule conductimétrique puissent être utilisées.
Préparation
- Laver la burette graduée avec de l’eau distillée puis faire passer une fois l’espèce titrante dans la burette.
- Placer ensuite l’espèce titrante dans la burette.
- Prélever un volume Vtitré de solution d’intérêt à l’aide d’une pipette jaugée et le placer dans un bécher préalablement rincé avec la solution d’intérêt puis séché. Ce prélèvement est parfois appelé prise d’essai.
- Ajouter un barreau aimanté et placer ce bécher sur un agitateur magnétique.
- Réaliser le titrage.
Réalisation
Lorsque l’expérimentateur cherche à déterminer la concentration de la solution d’intérêt Ctitré , il est conseillé de procéder à trois titrages au minimum:
- Un premier pour repérer le point de fin de titrage (titrage effectué rapidement sans trop attendre la stabilisation des mesures) ;
- Un deuxième pour avoir une première valeur du point de fin de titrage (Véq1) exprimé en tenant compte des incertitudes. Il faut en pratique resserrer les points de mesure, 1 à 2 mL avant jusqu'à 1 à 2 mL après le point de fin de titrage ;
- Un troisième pour vérifier la validité de cette valeur et écarter toute erreur aléatoire. La valeur du point de fin de titrage est notée Véq2.
Il faut vérifier que |Véq1 - Véq2| éq1 et Véq2 sont les volumes équivalents des deux dosages et ∆V l'incertitude associée au volume équivalent.
Finalement : Véq = [(Véq1 + Véq2) / 2] ± ΔV




