Quelles sont les bases de la spectroscopie d'absorption UV-visible ?
Intensité des bandes d’absorption
L’intensité des bandes d’absorption est reliée à la probabilité de la transition électronique, par un coefficient d'absorption molaire ε λmax valable à une longueur d'onde.
10 ≤ ε ≤ 1000
1000 ≤ ε ≤ 100000
ε ≥ 100000
transition faiblement permise
transition permise
transition permise
L’intensité des bandes d’absorption est mesurée par l'absorbance Aλ = log I0/I
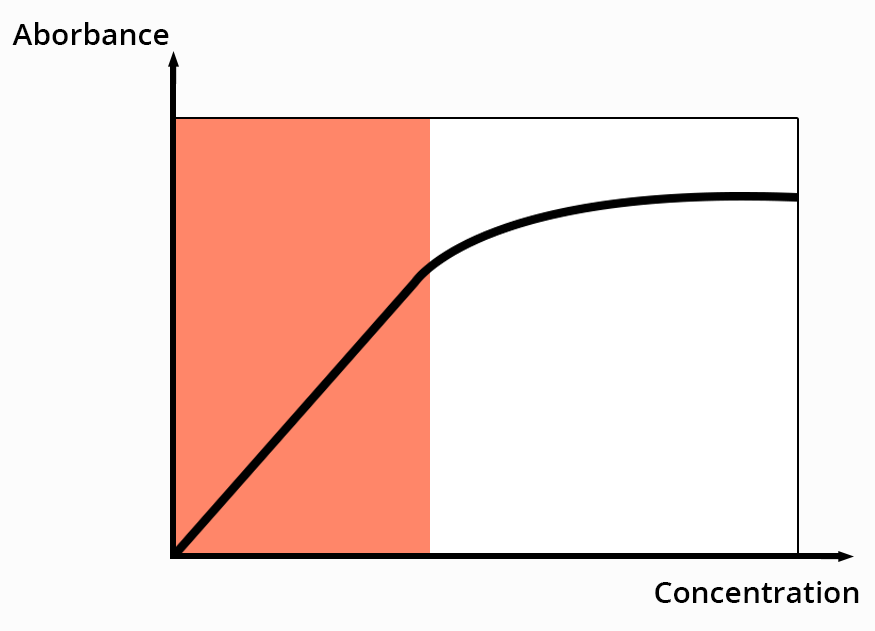
A longueur d'onde fixée, la loi de Beer-Lambert relie l'absorbance à la concentration des espèces en solution et à plusieurs constantes physiques.
avec ελ le coefficient d'absorption molaire (M-1.cm-1)
l le trajet optique (cm)
c la concentration (mol.L-1)
L'absorbance d'un composé dépend du nombre de chromophores présents dans la molécule.
Additivité de la Loi de Beer-Lambert
Pour une longueur d'onde donnée, l'absorbance d'un mélange est la somme des absorbances de chacune des molécules.
Tout comme la position des bandes d’absorption, leur intensité peut varier sous l'influence de certains paramètres (pH, solvant…).
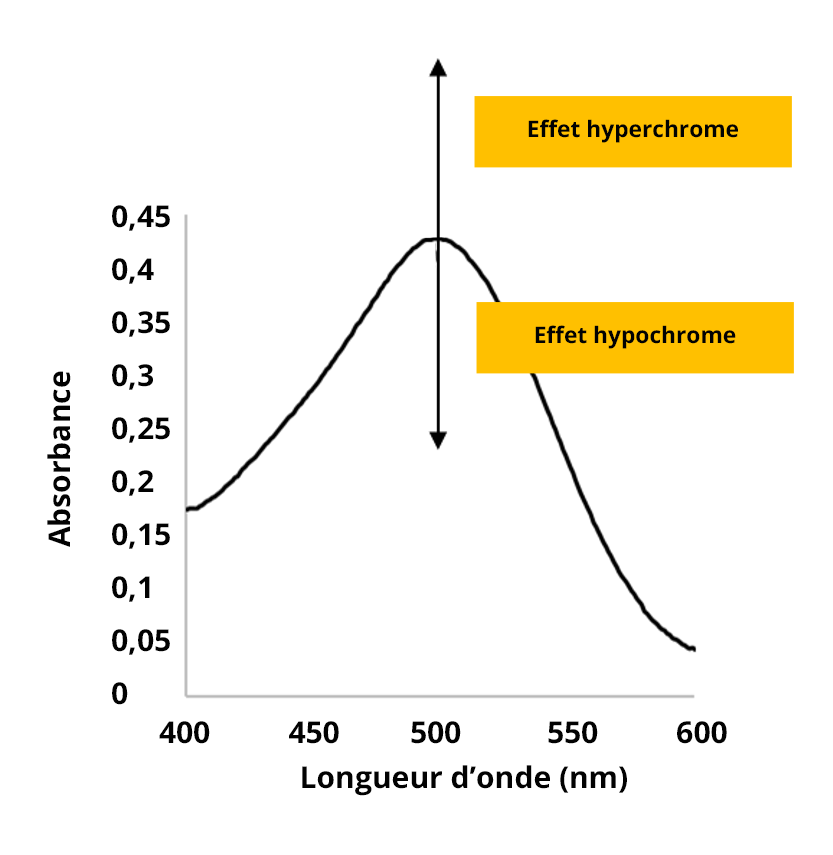
Effet hyperchrome
L'effet hyperchrome correspond à une augmentation de l’intensité du pic.
Effet hypochrome
L'effet hypochrome correspond à la diminution de l’intensité du pic.
L'absorbance d'un composé dépend du nombre de chromophores présents dans la molécule.