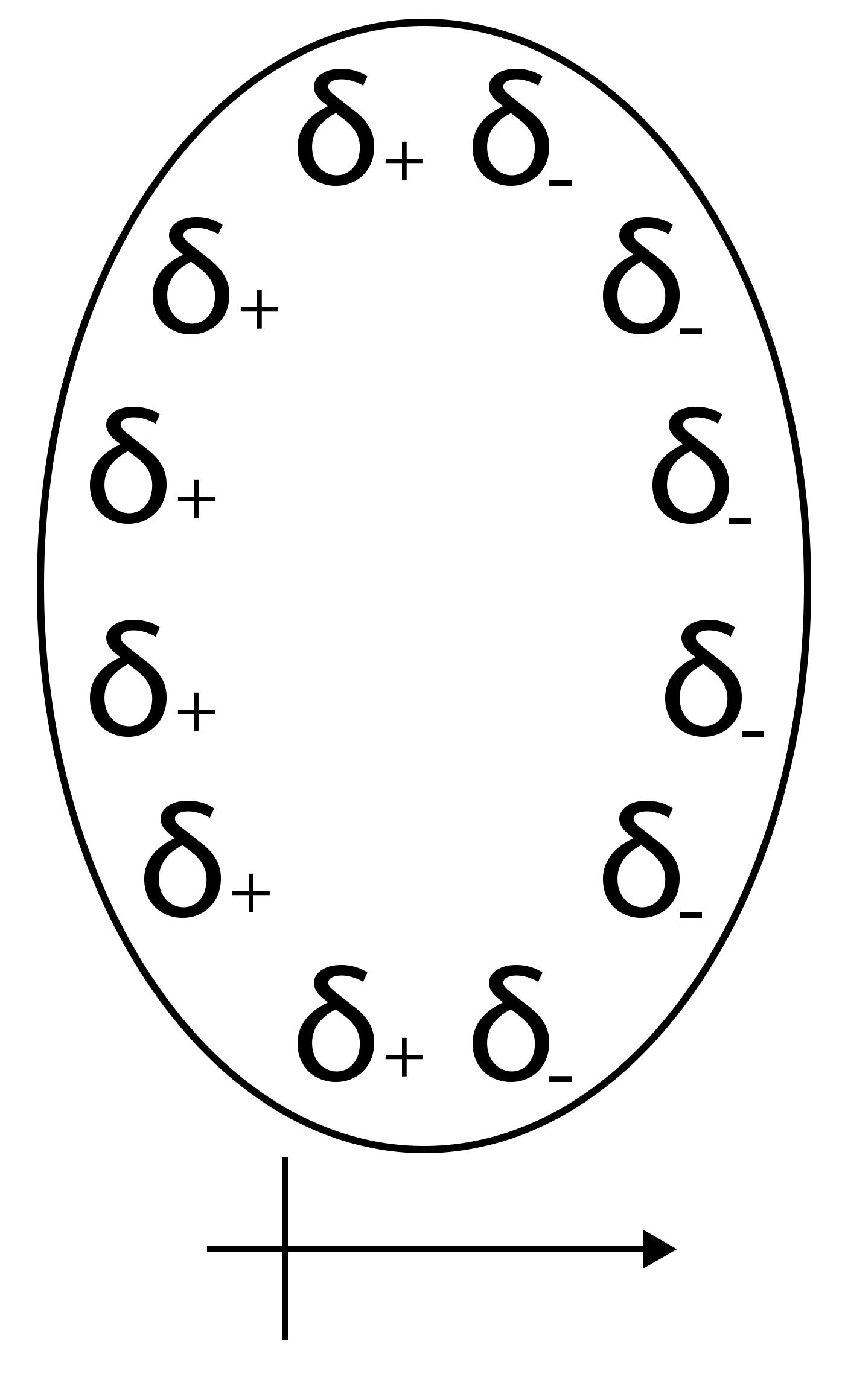
Les interactions de Van der Waals
On distingue 3 types de forces de Van der Waals :
- les forces d’orientation (ou forces de Keesom)
- les forces d’induction (ou forces de Debye)
- les forces de dispersion (ou forces de London)
Forces d’orientation
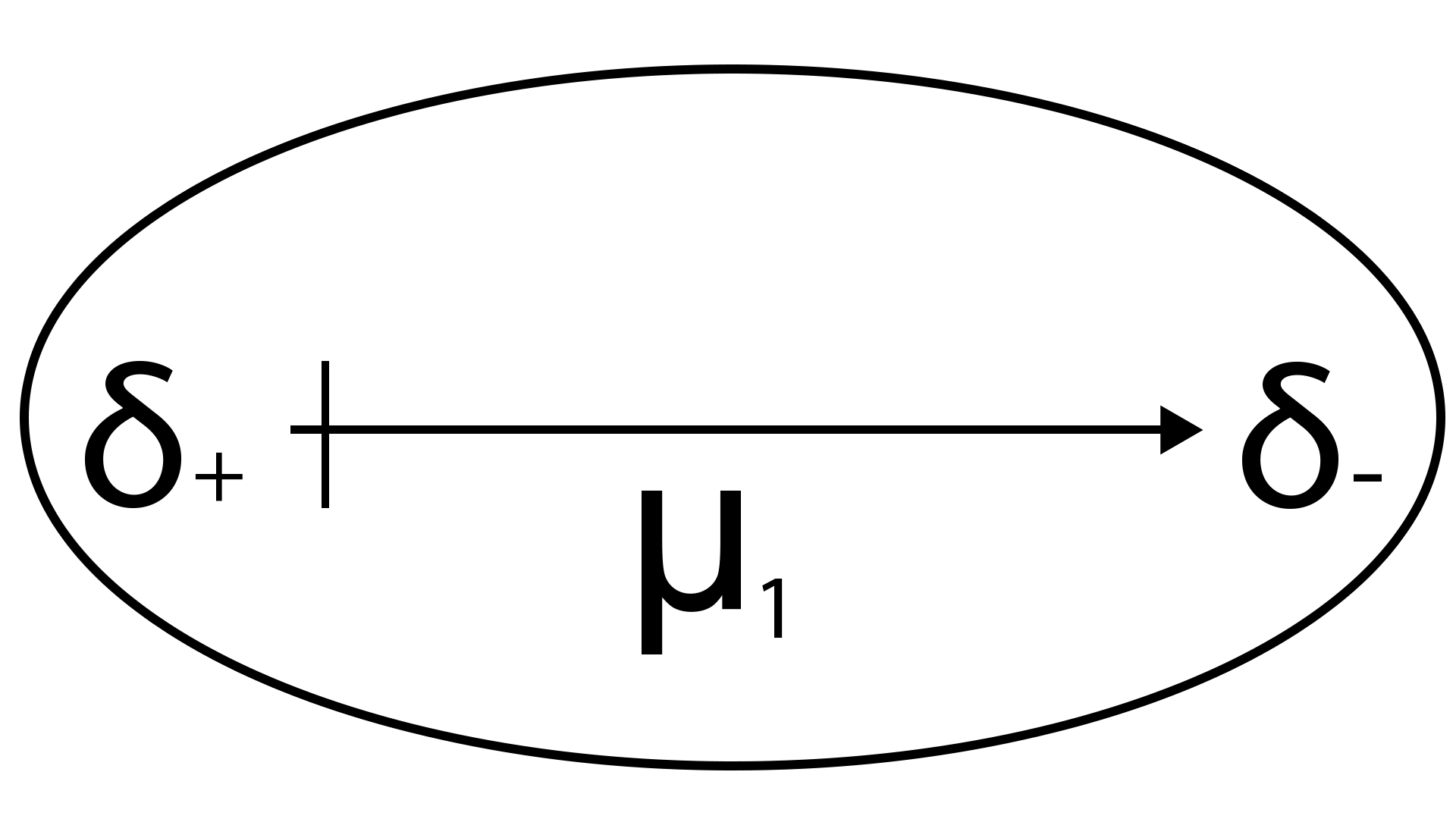
 L'énergie d'attraction dipôle-dipôle est donnée par la relation :
L'énergie d'attraction dipôle-dipôle est donnée par la relation :
r : distance entre les 2 dipôles
T : température
Forces d’induction

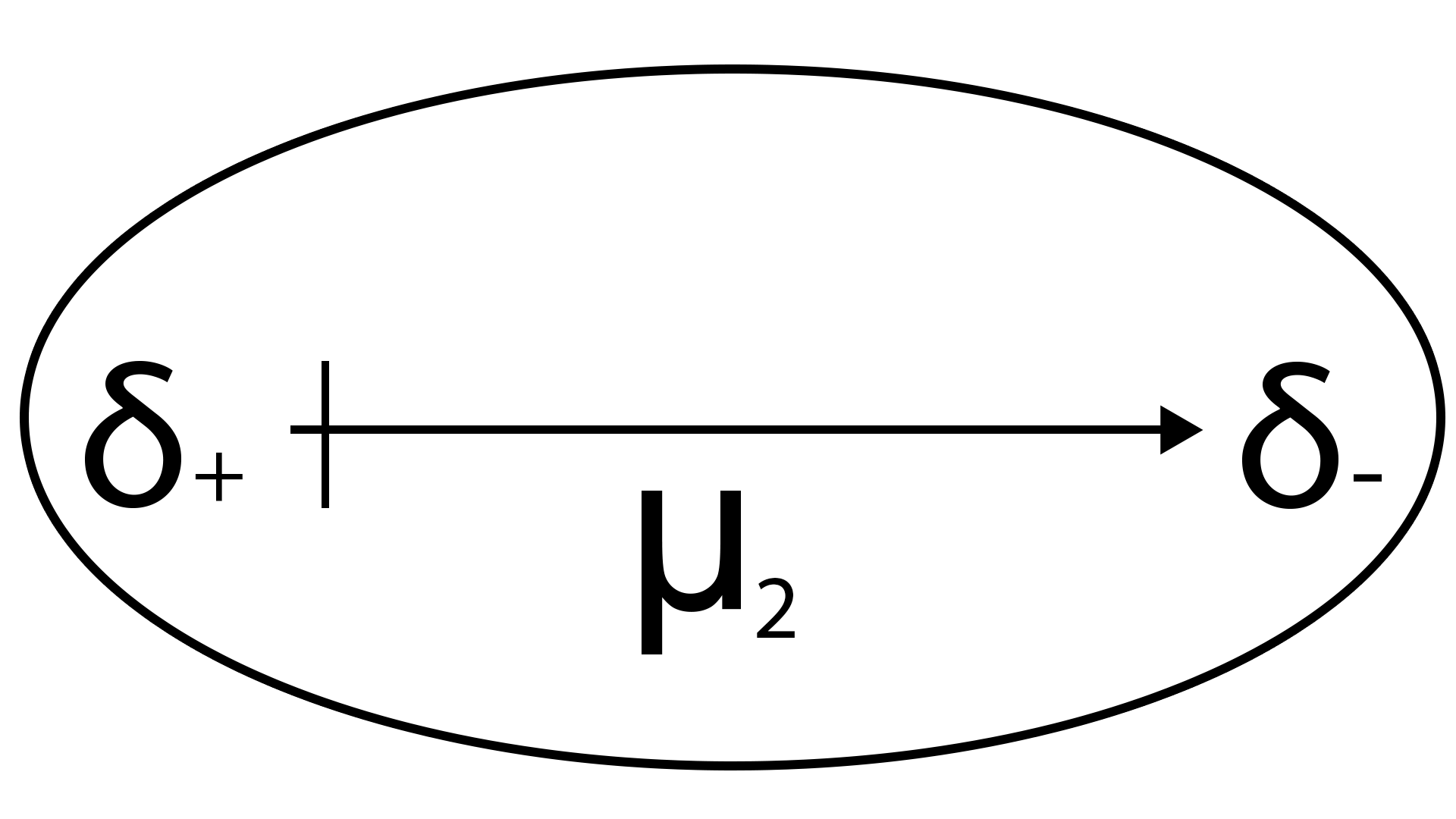
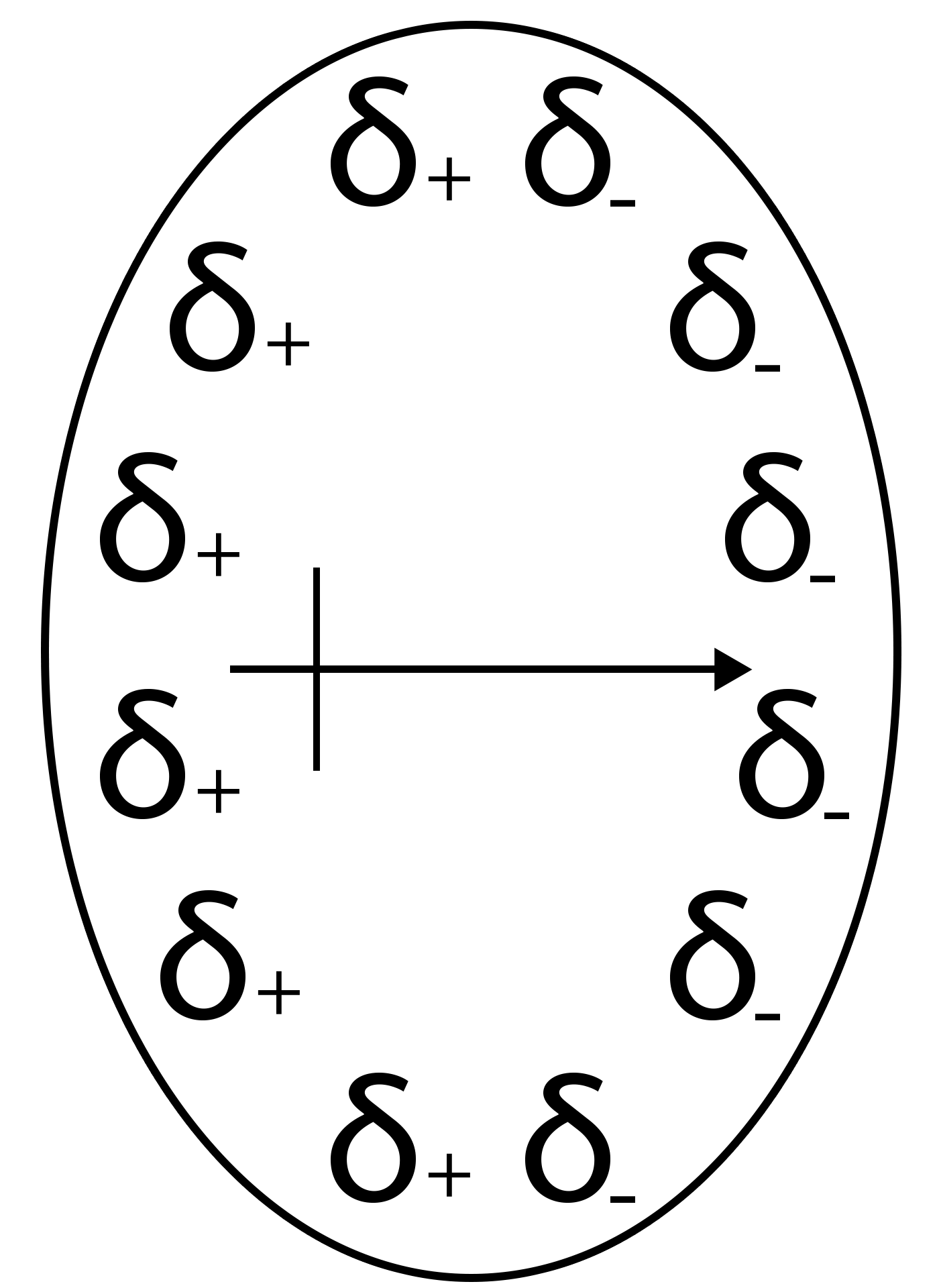 L'énergie d'attraction dipôle-dipôle est donnée par la relation :
L'énergie d'attraction dipôle-dipôle est donnée par la relation :
Forces de dispersion