Exemples d’applications
- Quantification de signaux dans un échantillon
- Dosage d’un mélange simple par RMN : détermination du titre alcoolique d’une solution d‘alcool de mirabelle artisanale par RMN 1H
- Etude quantitative d’un mélange de constituants inséparables par RMN 2H -{1H}
- Etude qualitative et quantitative des composants d’un mélange par RMN DOSY 1H : exemple d’un mélange de sucrose et glucose
- Détermination de grandeurs thermodynamiques et cinétiques
- Détermination du pKA d’un couple acide/base de Brönsted : exemple de la vitamine B1
- Echange lent ou rapide à l’échelle de temps RMN : exemple de la cis-decaline
- Echange lent ou rapide à l’échelle de temps RMN : détection de la chiralité atropoisomérique
Quantification de signaux dans un échantillon
- Détermination du T1 limitant
- séquence T1IR ou autre préliminaire après avoir optimisé les angles d’impulsion
- pour une acquisition impulsion one-pulse 90°, il faut attendre un minimum de AQ+RD ≥5T1 limitant
- Rapport S/B suffisant
- Pas d’apodisation (en pratique en exponentiel seulement si LB<FWHM)
- Correction de ligne de base
- Intégration (incluant une bonne correction des intégrales, complémentaire à la correction de ligne de base)
- Répétabilité de l’intégration : nI1 intégrations par le même opérateur pour une acquisition donnée
- Répétabilité de l’acquisition : nA expériences identiques répétées
- Reproductibilité de l’intégration: nI2 intégrations par un autre opérateur pour une acquisition donnée
- Si au moins un signal caractéristique de chaque composant du mélange est identifié et isolé spectralement, l’intégration est triviale
- Exemple : détermination du titre alcoolique d’une solution d’alcool de mirabelle
- Si les signaux sont non identifiés ou en partie superposés, expérience DOSY possible pour identifier les composants et se placer dans le cas précédent
- Exemple : identification spectrale de deux sucres d’un mélange
- Si l’identification est possible mais l’intégration n’est pas triviale, un traitement de déconvolution des signaux préliminaire à l’étape d’intégration doit être réalisé
- Exemple : détermination des excès enantiomérique et diastéréomérique dans un mélange inséparable de stéréoisomères
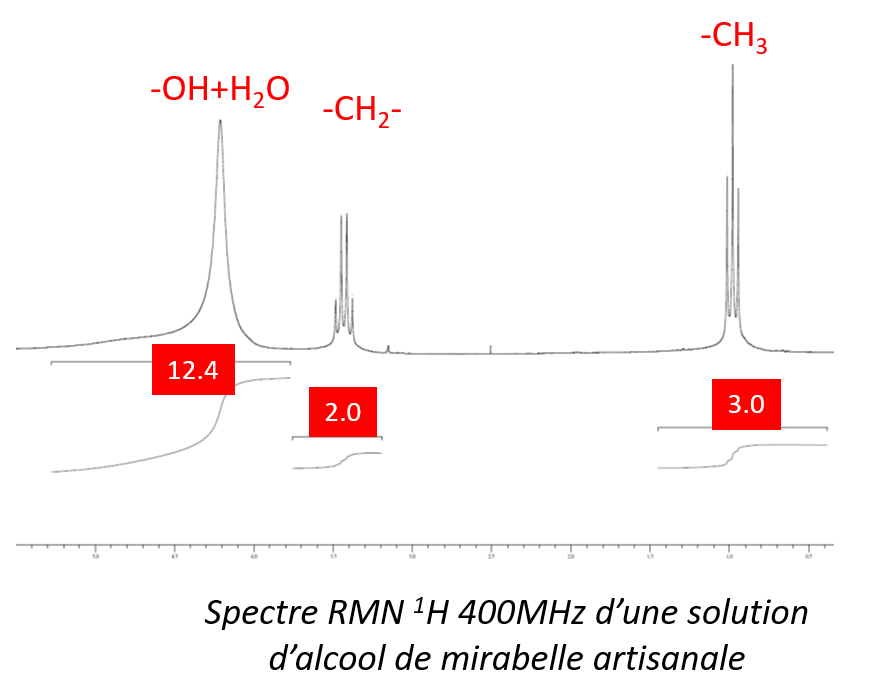
Dosage d’un mélange simple par RMN - détermination du titre alcoolique d’une solution d‘alcool de mirabelle artisanale par RMN 1H
Le titre alcoométrique volumique (TAV), ou degré alcoolique, définit la proportion d'alcool dans une boisson. Il s’agit du rapport entre le volume d'éthanol contenu dans le mélange et le volume total de ce mélange, à la température de 20 °C.
- A l’aide des signaux caractéristiques des groupements méthyle et méthylène, on détermine que chaque H de l’éthanol intègre pour 1
- On constate que le signal le plus déblindé est la superposition du signal du proton alcoolique de l’éthanol qui intègre pour 1, et du signal des deux protons équivalents de l’eau qui intègre pour 11,4
- On en déduit donc que pour une mole d’éthanol il y a dans le mélange 11,4/2 fois plus d’eau
- La conversion du rapport molaire en rapport volumique permet de déduire un titre alcoolique égal à 37° à 20°C (densité de l’éthanol égale à 0,789, densité de la solution alcoolique étudiée égale 0,95 ;

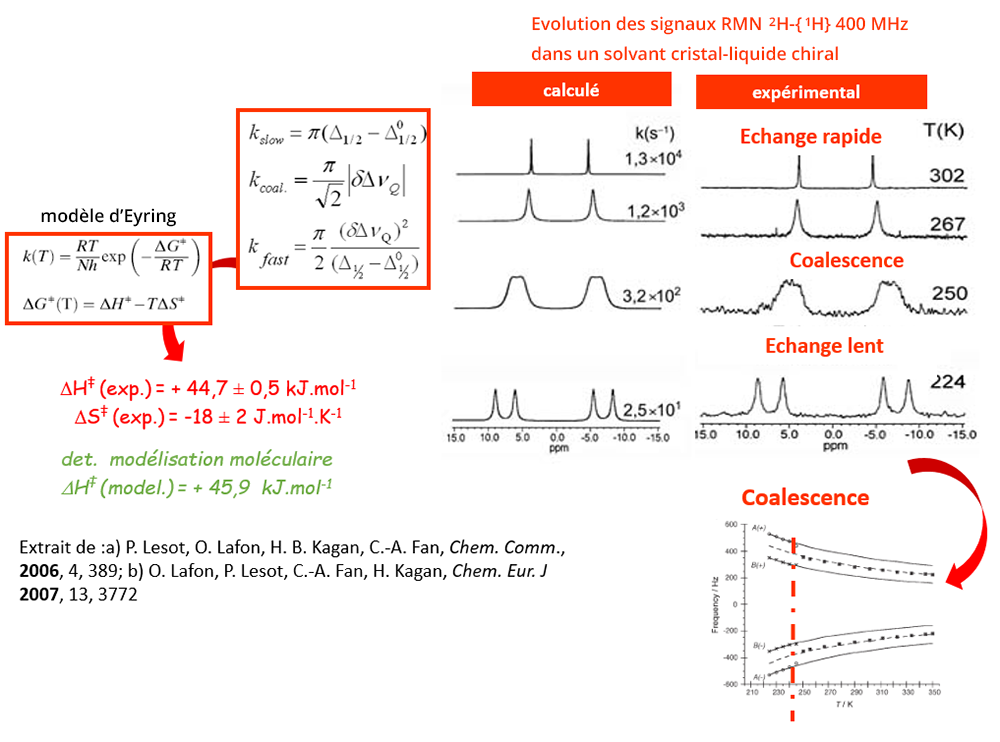
Etude quantitative d’un mélange de constituants inséparables par RMN 2H -{1H}
Il n’est pas toujours possible de différencier les spectres de molécules de structures chimiques proches tels que des diastéréoisomères. En outre, il est intrinsèquement impossible de différencier les signaux RMN d’un couple d’énantiomères en solvant achiral.
En revanche, dans un solvant chiral, les interactions énantiosélectives soluté-solvant vont permettre d’obtenir des signatures spectrales différentes pour les deux isomères optiques, et de mieux différencier les signaux des couples de diastéréoisomères. Si le solvant est par ailleurs cristal-liquide, l’interaction quadrupolaire n’est plus moyennée à zéro et il est possible d’observer un doublet quadrupolaire pour chaque deutérium des isomères considérés. Cela permet de diminuer la possibilité d’observer des recouvrements de raies, et d’augmenter le nombre de signaux exploitables pour quantifier leur intégrales.
Si les signaux ne sont pas suffisamment bien séparés, il est toujours possible de les décomposer pour mieux les quantifier. Le processus doit être répété trois à cinq fois pour obtenir l’incertitude de répétabilité, en ayant un rapport signal/bruit suffisant.
- Objectif : connaître e.e & e.d d’un mélange inséparable de stéréoisomères d,l/ méso

Etude qualitative et quantitative des composants d’un mélange par RMN DOSY 1H : exemple d’un mélange de sucrose et glucose
Les molécules en solution possèdent des propriétés dynamiques, notamment caractérisées par leur coefficient de diffusion, D. Ce coefficient dépend de la taille, de la masse moléculaire, de la forme de la molécule étudiée, ainsi que de la température et de la viscosité η de la solution. Le modèle de Stockes-Einstein est le plus simple et le plus usuel pour déduire une taille approximative de la molécule solvatée à l’aide de son rayon hygrodynamique Rh, en la considérant de forme sphérique. Des modèles plus sophistiqués, incluant des facteurs de forme par exemple, existent.

L’expérience DOSY consiste à séparer les constituants d’un mélange en jouant sur leur capacités à diffuser différemment dans la solution dans laquelle ils sont impliqués. A l’issue de cette expérience est obtenue une carte bidimensionnelle dont la dimension horizontale est occupée par le spectre RMN 1D du mélange (1H généralement), et la dimension verticale est une échelle de coefficients de diffusion, éventuellement présentée sous forme logarithmique. La diffusion étant un mouvement qui caractérise une molécule donnée, l’ensemble des signaux RMN appartenant à la même espèce chimique apparaît sur la même ligne de la carte DOSY.
Qualitative and quantitative study of the components of a mixture with DOSY 1H NMR: Example of a mixture of sucrose and glucose
Voir figure 14 dans “Concepts in Magnetic Resonance, (2002), 14 (4), 225”
Détermination du pKA d’un couple acide/base de Brönsted : exemple de la vitamine B1

- Les déplacements chimiques des noyaux d’une molécule rendent compte de l’environnement chimique que chacun perçoit. Cet environnement est dépendent du solvant, des éventuelles impuretés en solution, de la température et notamment du pH de l’échantillon RMN lorsque le soluté étudié possède des propriétés acido-basiques comme la thiamine ou vitamine B1.
- Bien que le déplacement chimique soit une grandeur composite dans laquelle chaque contribution n’évolue pas de la même façon en fonction de la température ou du pH, il est possible en général de suivre le déplacement chimique en fonction du pH comme observable RMN pour déterminer le pKA du couple considéré.
- La détermination est réalisée à partir de l’ajustement numérique de la courbe
 ou de la fonction
ou de la fonction 
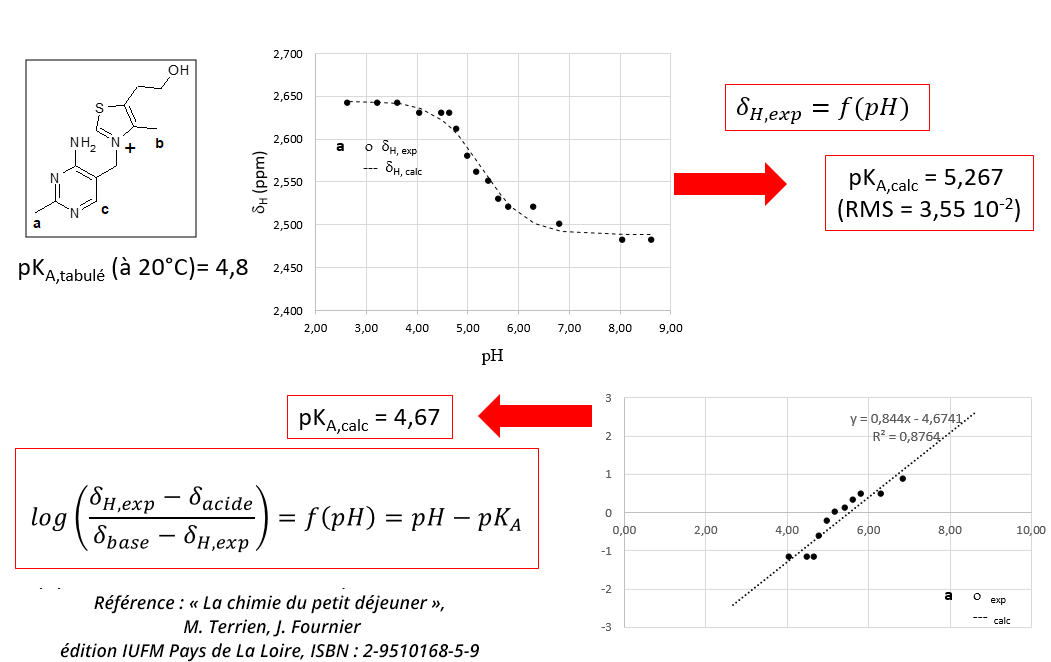
- La qualité de la détermination dépend de la qualité des mesures exploitées. Dans le cas de la thiamine, les signaux ont été enregistrés à 60 MHz.
Echange lent ou rapide à l’échelle de temps RMN
Lorsque le soluté étudié adopte une certaine flexibilité, les déplacements chimiques observés sont modulés par la courbe de distribution conformationnelle, et par la vitesse de l’échange conformationnel entre les différents conformères. Il en est de même lorsque un site est en échange chimique tels que les protons à caractère acide des alcools, acides ou encore amines.
L’analyse des signaux RMN en fonction de la température peut permettre de déterminer les caractéristiques cinétiques de l’échange étudié. A l’aide de modèles adéquats, comme le modèle d’Eyring, il est possible de remonter à des données thermodynamiques.

NB : si les deux conformations ne sont pas de même énergie, il faut prendre en compte les populations de chacune (reference OCP Hore)
- La vitesse d’échange dépend de la flexibilité de la molécule, de sa symétrie et des sites étudiés. Dans le cas de la cis-décaline, les sites 9 et 10 (jonction de cycles) sont toujours en échange rapide aux températures choisies. Les sites en alpha et beta de la jonction de cycle sont en échange lent en deça de 12°C. Au-delà du point de coalescence, la symétrie d’ordre 4 des signaux observés est supérieure à la symétrie moléculaire d’ordre 2, en raison de la dynamique rapide qui module les signaux observés.

Echange lent ou rapide à l’échelle de temps RMN : détection de la chiralité atropoisomérique

- Les deux composés constituent un couple d’atropoisomères : leur relation d’énantiomérie provient de l’encombrement stérique des cycle phényle et naphtyle l’un par rapport à l’autre en raison de l’encombrement des atomes d’hydrogène en alpha de la jonction de cycle. Lorsque la température est suffisamment élevée pour que la dynamique moléculaire permette de passer outre la barrière d’activation, les deux énantiomères ne sont plus discernables.
- Dans un solvant chiral, il est possible d’observer des signaux RMN différents pour chaque énantiomère en raison des interactions énantioselectives soluté-solvant. Pour étudier ce phénomène d’échange conformationnel, la RMN dans un tel solvant est donc bien adaptée. De plus, si la molécule est deutérée, il est possible de simplifier grandement l’observation du phénomène d’atropoisomérie en observant le spectre RMN 2H-{1H}.
- Dans un solvant cristal-liquide, le deutérium, noyau quadrupolaire de spin I=1, donne naissance à un doublet quadrupolaire. Si le solvant cristal-liquide est chiral, un doublet quadrupolaire par énantiomère est observé si l’échange est lent.
- Le suivi en température des signaux RMN permet de déterminer la cinétique du système étudié. A l’aide d’un modèle comme celui d’Eyring, il est possible de déduire les grandeurs thermodynamiques qui caractérisent l’échange conformationnel.