Dosage de l’oxygène dissous avec une cellule de Clark
Principe de fonctionnement
L’application d’une différence de potentiel ddp (entre 700 et 1200 mV), entraine une électrolyse : l’électrode de platine (ou d’or) joue le rôle de cathode (réduction) et celle d’argent le rôle d’anode (oxydation). Les réactions sont :
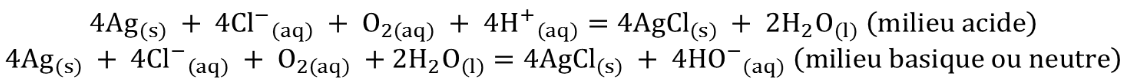
Au moyen d’un microampèremètre, le courant cathodique IC est mesuré et correspond au courant limite de diffusion pour la réaction de réduction de O2 en HO- ou H2O Iclim . L’intensité de ce courant est directement proportionnelle à la vitesse de diffusion de O2 vers la cathode et la concentration en dioxygène [O2] en solution selon :
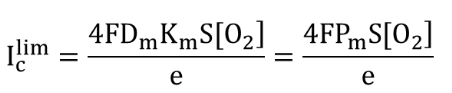
avec F la constante de Faraday, Dm le coefficient de diffusion de O2 à travers la membrane, Km la constante de solubilité de O2 dans la membrane, Pm la perméabilité de la membrane qui vaut DmKm, S la surface de l’électrode et e l’épaisseur de la membrane.
Les concentrations en dioxygène dans la solution électrolytique et à l’extérieur de la cellule sont en équilibre : si la concentration en dioxygène en solution augmente alors celle dans la solution électrolytique également. Ceci permet donc de déterminer la concentration en O2 via la mesure du courant limite de diffusion de la réaction de réduction.