Dosage de l’oxygène dissous par titrage colorimétrique : méthode de Winkler
Principe du dosage
La détermination de la concentration en O2 repose sur l’addition de MnCl2 à l’eau à analyser après s’être placé à un pH basique grâce à l’ajout de soude en pastille. À ce pH, les ions Mn2+ précipitent sous forme d’hydroxyde Mn(OH)2 et réagissent avec O2 dissous (1). Un solide de couleur marron caractéristique de Mn(OH)3 se forme. Après un temps donné, il y a addition d’acide sulfurique (2) puis d’iodure de potassium (3). Finalement, il y a titrage du diiode formé par une solution de thiosulfate de sodium (4).
(1) Mn2+(aq) + 2HO-(aq) = Mn(OH)2(s) et O2(aq) + 4Mn(OH)2 (s) + 2H2O(l) = 4Mn(OH)3(s)
(2) Mn(OH)3(s) + 3H+(aq) = Mn3+(aq) + 3H2O(l)
(3) 2Mn3+(aq) + 2I-(aq) = I2(aq) + 2Mn2+(aq)
(4) I2(aq) + 2 S2O32- (aq) = 2 I-(aq) + S4O62-(aq)
(2) Mn(OH)3(s) + 3H+(aq) = Mn3+(aq) + 3H2O(l)
(3) 2Mn3+(aq) + 2I-(aq) = I2(aq) + 2Mn2+(aq)
(4) I2(aq) + 2 S2O32- (aq) = 2 I-(aq) + S4O62-(aq)
Données :
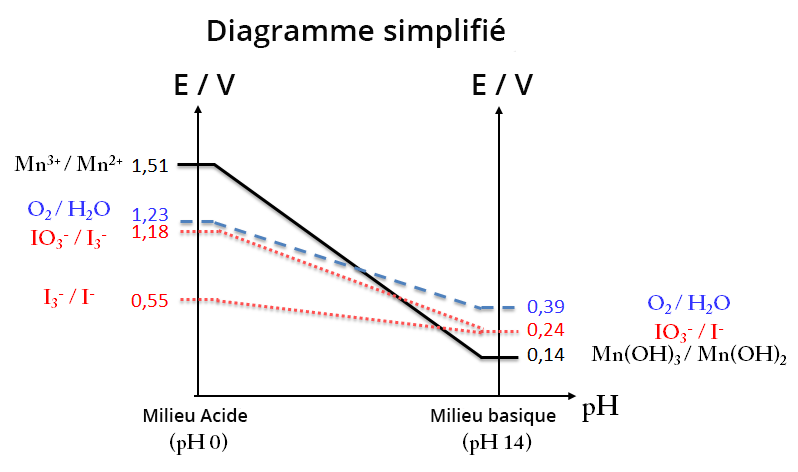
pKS (Mn(OH)2) = 12,7 ; pKS (Mn(OH)3) = 36 ; E° (Mn3+/Mn2+) = 1,51 V ;
E° (Mn(OH)3/Mn2+) = 2,01 V ; E° (Mn(OH)3/Mn(OH)2) = 0,98 V ; E° (I2 /I-) = 0,55 V ;
E° (S4O62-/S2O32- ) = 0,08 V.
Diagramme E-pH (Mn, I2 et H2O)