Dosage des ions Cl- par titrage colorimétrique : méthode de Fajans
Principe du dosage
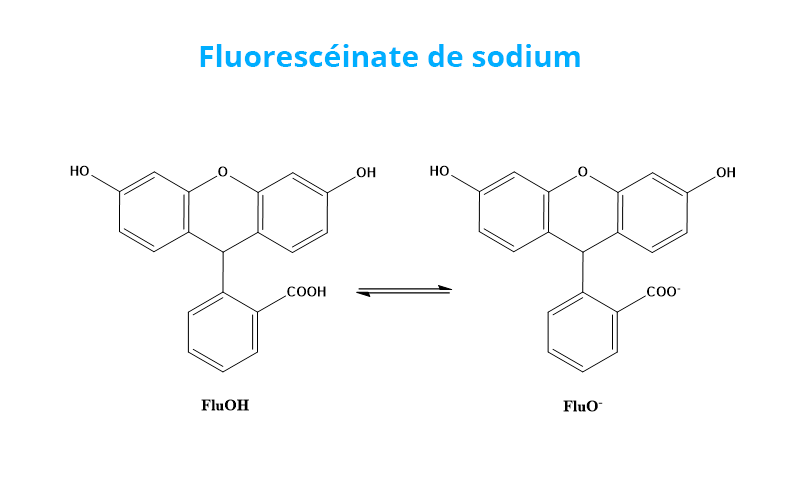
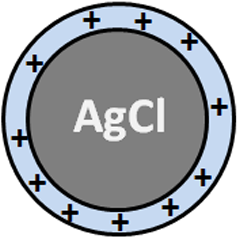
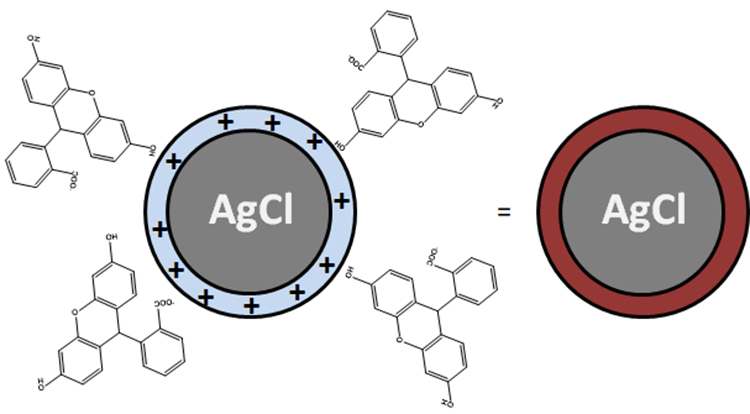
La détermination de la concentration en Cl- repose sur le titrage des ions Cl- par addition de nitrate d’argent AgNO3 en présence de fluorescéinate de sodium (FluoNa). Un solide blanc de AgCl se forme (1) avant l’équivalence puis, lorsque l’on atteint l’équivalence, la solution prend une couleur orange caractéristique de l’adsorption de Fluo- à la surface des particules de AgCl (2). En effet, avant l’équivalence, les ions Cl- sont en excès dans le milieu si bien que la surface des particules de AgCl formées est chargée négativement. Après l’équivalence, les ions Ag+ sont en excès dans le milieu si bien que la surface des particules de AgCl formées est chargée positivement (1’). Fluo- peut alors s’adsorber à la surface des particules pour former AgCl(s)-Fluo(ads) *.
(1’) AgCl(s) (surface chargée négativement) + Ag+ = AgCl(s) (surface chargée positivement) + Ag+
(2) AgCl(s) (surface chargée positivement) = AgCl(s)-Fluo(ads)
Données :
pKs(AgCl) = 9,8 ; pkA (FluOH/FluO-) = 6,4.
*Il ne s’agit pas de la précipitation de Ag-Fluo(s) car la concentration en FluO- est trop faible pour atteindre la limite de solubilité.