Dosage des ions SO42- par titrage conductimétrique
Principe du dosage
La détermination de la concentration en SO42- repose sur le titrage des ions SO42- par addition de chlorure de baryum BaCl2. Un solide blanc de BaSO4(s) se forme :
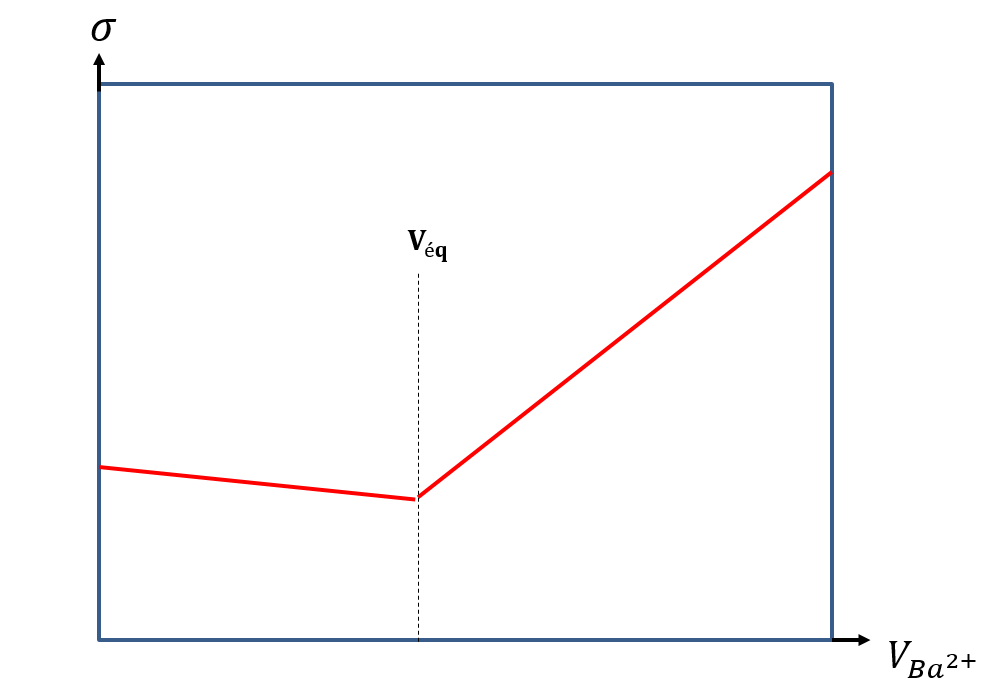
Ce titrage est suivi par conductimétrie. Avant l’équivalence, les ions SO42- en solution (en sus des autres ions présents dans l’eau à analyser) sont consommés par l’ajout de Ba2+ et des ions chlorure sont ajoutés au milieu. Comme 𝜆°(Cl-) 42-), la conductivité de la solution diminue légèrement. Après l’équivalence, les ions Ba2+ et Cl- sont ajoutés au milieu sans qu’ils soient consommés. La conductivité de la solution augmente alors fortement.
Remarque :
En pratique, il arrive souvent qu’avant l’équivalence, la conductivité augmente notablement contrairement à ce qui est théoriquement prévu ci-dessous. Cette augmentation est due à la formation en solution de paires d’ions solvatées (Ca2+, SO42-)(aq) notamment dans les eaux riches en calcium. Ces paires d’ions sont neutres et ne participent donc pas à la conductivité. Elles sont de plus en équilibre avec des ions Ca2+ et SO42- en solution dits libres selon l’équation de réaction :
Lors du titrage, avant l’équivalence, l’ajout de Ba2+ entraine la formation de BaSO4(s) par réaction avec les ions SO42-(aq) libres. Les ions SO42-(aq) sont consommés ce qui déplace l’équilibre ci-dessus et entraine la dissociation des paires d’ions neutres en ions Ca2+(aq) et SO42-(aq). Lors de l’ajout de BaCl2 avant l’équivalence, en plus des ions SO42- consommés et des ions Cl- ajoutés (provenant de BaCl2), le milieu s’enrichit en ions Ca2+ et de nouveaux ions SO42- issus de la dissociation des paires d’ions. Ceci explique ainsi l’augmentation de conductivité souvent observée.
Consulter la fiche conductimétrieDonnées :
pKs(BaSO4) = 9,9 ; 𝜆°(Ba2+) = 12,72 ; 𝜆°(Cl-) = 7,63 ; 𝜆°(SO42-) = 16.