Dosage des ions calcium & magnésium par titrage colorimétrique
Principe du dosage
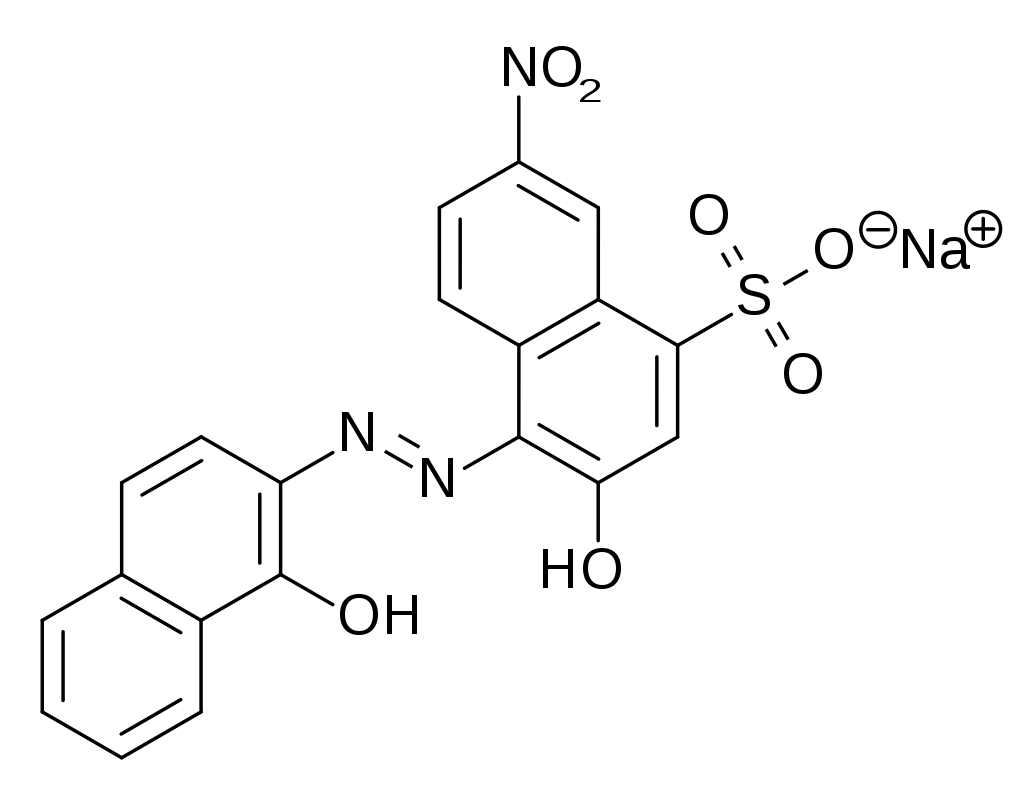
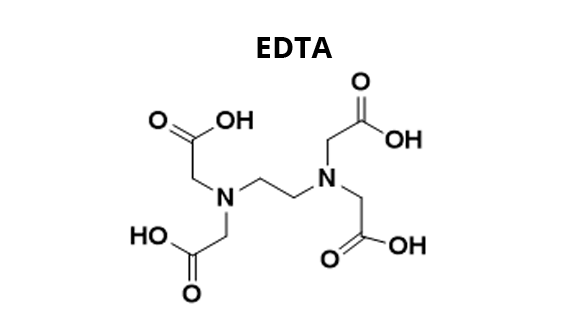
La détermination de la dureté de l’eau repose sur l’addition de noir eriochrome T (NET) à l’eau à analyser pour former des complexes Mg-NET et Ca-NET (1). La solution prend une couleur rouge-violette caractéristique de ces complexes. On se place à pH 10 grâce à l’ajout d’une solution tampon. On titre ensuite la solution obtenue par l’acide éthylène diamine tétracétique (EDTA). Il y a dans un premier temps formation de complexes Mg-EDTA et Ca-EDTA avec les ions Mg2+ et Ca2+ libres (i.e. non complexés au NET) (2) puis les ions complexés au NET (3). Ceci libère alors le NET en solution, et la solution prend une couleur bleue caractéristique de cette molécule à pH 10.
(1) Mg2+(aq) + NET(aq) = Mg-NET(aq) et Ca2+(aq) + NET(aq) = Ca-NET(aq)
(2) Mg2+(aq) + EDTA(aq) = Mg-EDTA(aq) et Ca2+(aq) + EDTA(aq) = Ca-EDTA(aq)
(3) Mg-NET(aq) + EDTA(aq) = Mg-EDTA(aq) + NET(aq) et Ca-NET(aq) + EDTA(aq) = Ca-EDTA(aq) + NET(aq)
(2) Mg2+(aq) + EDTA(aq) = Mg-EDTA(aq) et Ca2+(aq) + EDTA(aq) = Ca-EDTA(aq)
(3) Mg-NET(aq) + EDTA(aq) = Mg-EDTA(aq) + NET(aq) et Ca-NET(aq) + EDTA(aq) = Ca-EDTA(aq) + NET(aq)
Données :
pKS (Ca(OH)2) = 5,26 ; pKS (Mg(OH)2) = 9,2; logβ (Ca-NET)= 5,4 ; logβ (Mg-NET)= 7,0 ; logβ (Ca-EDTA)= 10,7 ; logβ (Mg-EDTA)= 8,6.