Quelles sont les bases de l'HPLC ?
La pompe : le début de la phase mobile
Les pompes en HPLC jouent un rôle majeur. Elles permettent la circulation de la phase mobile dans l’ensemble du système. Ce sont également elles qui vont contrôler la composition de la phase mobile à travers plusieurs modes de fonctionnement.
La phase mobile
En HPLC, la composition de la phase mobile est primordiale pour favoriser les interactions avec la colonne ou au contraire favoriser l’élution des composés.
La majorité des appareils d’HPLC peuvent soit maintenir la composition de la phase mobile durant toute l’analyse : mode isocratique, soit faire évoluer la composition de la phase mobile au cours de l’analyse : mode gradient.
En chromatographie de partage en phase inverse (qui est la plus utilisée), les solvants utilisés sont souvent une phase aqueuse (appelée solvant A) et une phase organique (appelée solvant B).
Savez-vous pourquoi il est préférable que le flacon de la phase aqueuse soit ambré ? La réponse en cliquant ici
Composition de la phase mobile
Contrairement à la chromatographie gazeuse, en HPLC la phase mobile joue un rôle majeur dans la migration des composés. Ainsi, bien choisir la phase mobile en HPLC est crucial pour réussir son analyse.
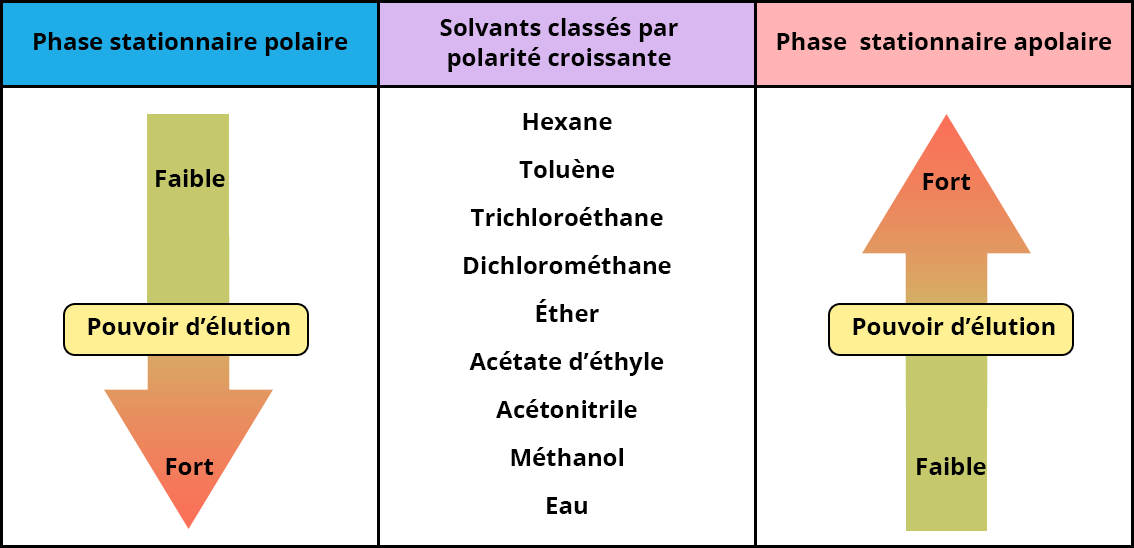
Le pouvoir d’élution du solvant selon le type de chromatographie liquide
Les solvants devant servir à aider la rétention et/ou l’élution des composés dans une colonne chromatographique pour favoriser la séparation des composés, il est primordial de connaitre le pouvoir d’élution des solvants les plus couramment utilisés en HPLC.
La figure ci-dessous, classe les différents solvants organiques en fonction de leur polarité croissante et indique leur pouvoir d’élution pour l’utilisation d’une séparation en phase normale ou une séparation en phase inverse
Plus le pouvoir d’élution sera fort, plus le solvant sera efficace pour éluer les composés de la colonne
Dans le cas de la chromatographie ionique, le solvant utilisé dépend du type de rétention attendu
- Rétention des anions : mélange hydrogénocarbonate de sodium (NaHCO3) et carbonate de sodium (Na2CO3) -> facilement éliminé grâce à un suppresseur anionique (échange ion Na+ contre H+ et HCO3- + H+ = H2O + CO2)
- Rétention des cations : acide chlorhydrique (HCl) -> facilement éliminé grâce à un suppresseur cationique (Cl- remplacé par OH- et H+ + OH- -> H2O)
Ainsi grâce à ces deux phases mobiles et l’utilisation de suppresseur d’ions, l’analyse des ions généralement faite avec un conductimètre n’est pas perturbée par la présence des ions de la phase mobile, permettant d’augmenter la sensibilité de l’analyse.
Consulter la fiches "Les produits chimiques"Les mélanges de solvants
En HPLC, il est possible de n’utiliser qu’un seul solvant, mais la majorité des appareils permettent d’utiliser un mélange de solvants (soit préparé en amont, soit fait automatiquement par les pompes). Certains appareils, permettent de faire des mélanges jusqu’à 4 solvants simultanément.
Néanmoins, l’utilisation de plusieurs solvants nécessite de s’assurer de leur miscibilité. En effet, utiliser deux solvants non miscibles rendrait le mélange de solvants inopérant et perturberait fortement la rétention des composés dans la colonne et la répétabilité des analyses.
Ajout d’additifs dans la phase mobile
Dans certains cas, les solvants ne suffisent pas à assurer une bonne séparation chromatographique ou une bonne analyse. Il est donc nécessaire d’utiliser des additifs qui vont modifier les propriétés de la phase mobile et changer les conditions de rétention ou d’analyse.
Voici quelques cas d’utilisation d’additif dans les phases mobiles :- Stabilisation du pH pour la séparation de composés acides : utilisation de 0,1% d’acide formique. Dans ce cas, l’acide formique ajouté à 0,1% permet de stabiliser le pH autour de 3. De ce fait, comme le pH En général la forme des pics chromatographiques est grandement améliorée.
- Amélioration de l’analyse par spectrométrie de masse : utilisation de 0,1% d’acide formique ou 10 mM d’hydroxyde d’ammonium (NH4OH) ou de formate d’ammonium (COONH4). Ces additifs vont permettre d’améliorer l’analyse des composés par spectrométrie de masse, en favorisant leur ionisation (cf, la spectrométrie de masse)
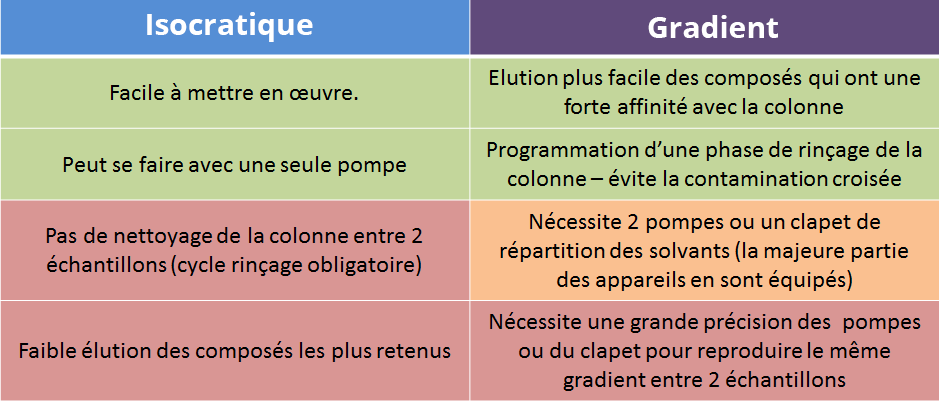
Elution isocratique ou avec gradient ?
L’élution isocratique
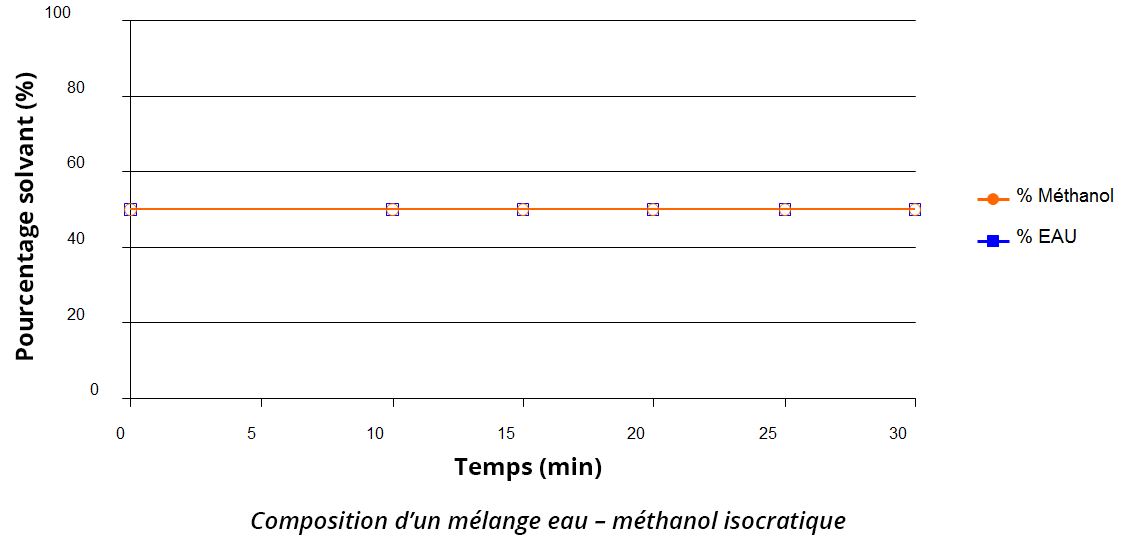
La composition de la phase mobile n’évolue pas durant l’analyse. Si la phase mobile est un mélange, le pourcentage de chaque solvant dans ce mélange reste constant tout au long de l’élution (voir exemple de phase mobile eau/méthanol 50/50 v/v).
Gradient d’élution :
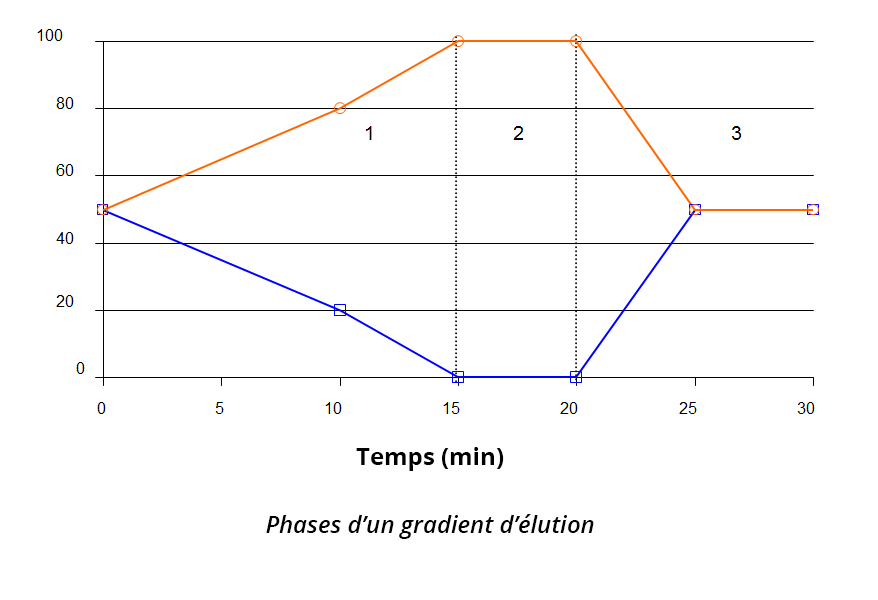
La composition de la phase mobile évolue au cours de l’élution, ce qui permet de séparer des composés difficiles à séparer en mode isocratique.
On opère généralement en 3 phases :
- Elution des composés
- Rinçage de la colonne
- Reconditionnement
Le gradient d’élution est particulièrement utilisé pour l’analyse d’échantillons complexes ou/et d’analyses multi-composés. Le gradient permet à la fois de bien séparer les différents composés à éluer de la colonne, mais également de bien rincer la colonne entre deux injections pour éviter l’encrassement de la phase stationnaire injection après injection.
Dégazer ou ne pas dégazer ?
Tout solvant en contact avec l’atmosphère va dissoudre des gaz (dont l’oxygène) jusqu’à atteindre le point d’équilibre entre les deux phases. Les gaz, ainsi dissous, sont susceptibles de perturber le mélange de deux solvants en générant, à haute pression, des microbulles qui peuvent perturber l’analyse (rétention et/ou détection). En outre, la présence d’oxygène peut entrainer une oxydation des capillaires métalliques et de la phase stationnaire de la colonne
Il est donc important en chromatographie de s’assurer que les solvants ne contiennent plus (ou peu) de gaz dissous au moment de leur mélange pour éviter l’apparition de microbulles. Pour cela deux solutions :
- l’appareil est équipé d’un dégazeur en ligne sous vide. Le dégazeur est généralement placé entre les bouteilles de solvants et les pompes.
- Par barbotage ou bain à ultrasons. Le barbotage sert à remplacer les gaz dissous par un gaz inerte pour éviter l’oxydation, tandis que le bain à ultrasons permet la volatilisation des gaz dissous. Dans l’idéal après ce type de dégazage, les bouteilles doivent être conservées sous vide ou sous atmosphère contrôlée (sans quoi les gaz de l’atmosphère vont de nouveau se dissoudre). Attention : le bain à ultrasons chauffe le solvant et risque d’évaporer les solvants organiques, pratiquer cette étape sous hotte si elle est nécessaire.