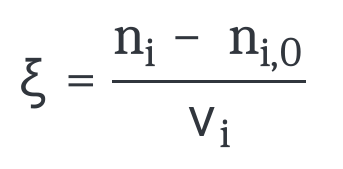Réaction de titrage
Dans le cas d’un titrage, l’expérimentateur fait réagir un soluté appelée titrant (R, Ctitrant) de concentration connue avec le soluté de concentration inconnue appelée titré (T, Ctitré) .
La réaction de titrage peut s’écrire :
ν1T + ν2R →
produits du titrage
Réaction équilibrée, quantitative et totale
Des réactions chimiques sont équilibrées s'il y a coexistance de tous les réactifs et produits de la réaction que l'on atteint l'équilibre chimique.
L'avancement final ξf (après un temps de réaction infini) est donc assez loin de l'avancement maximal ξmax (lorsque le réactif limitant a été totalement consommé). L’avancement d’une réaction ξ est défini comme :
avec
ni,0 : la quantité de matière initiale (t = 0) du constituant i
ni : la quantité de matière au temps t du constituant i
vi : le coefficient stoechiométrique du constituant i
Les valeurs de K° sont donc supérieures (respectivement inférieures) à l'unité si l'équilibre est en faveur des produits (respectivement des réactifs). Pour K°= 1, la réaction n'est ni en faveur des produits ni réactifs.
Une réaction est qualifiée de totale si on a une disparition totale de réactifs, c'est à dire qu'on a atteint l'avancement maximal ξmax (ξf = ξmax). Le taux d'avancement final τf est égal à 1. Plus précisément, dans le cas d'une réaction totale, le système évolue jusqu'à son terme.
Une réaction est qualifiée de quantitative si l'équilibre est fortement en faveur des produits sans nécessairement atteindre l'avancement maximal ξmax. Le taux d'avancement final τf est inférieur à 1 mais proche de 1 (≈ 0,95 - 1).
Taux de conversion ou d'avancement d'une réaction chimique
Le taux de conversion ou d'avancement t est défini par rapport réactif limitant comme :
avec :
n
i,0 : la quantité de matière initiale (t = 0)
n
i : la quantité de matière au temps t
v
i : le coefficient stoechiométrique du réactif limitant
ξ : l'avancement de la réaction
Le
taux d'avancement final τf est tel que :
Le taux de conversion est
sans unité et est particulièrement intéressant lorsqu'on est dans les proportions stoechiométriques. Dans ce cas, le taux de conversion est le même pour tous les réactifs.