1) Verser un volume suffisant de solution échantillon dans un récipient propre de sorte que la jonction liquide de l’électrode (diaphragme) soit immergée dans l’échantillon.
2) S’assurer que la température de l’échantillon est connue ou qu’elle est mesurée pendant la détermination du pH par un capteur de température intégré ou séparé.
4) Agiter doucement l’échantillon et plonger l’électrode de pH dans la solution.
5) Presser le bouton mesure du pH-mètre et attendre une valeur stable.
6) Retirer l’électrode de la solution et la rincer à l’eau distillée ou déminéralisée.
Effet sur la dissociation de la molécule.
Effet de la température sur la mesure de pH ?
- Effet sur la dissociation de la molécule
HA + H2O ⇔ H3O+ + A-
Equilibre défini par la constante de dissociation

Qui dépend de la température selon la loi de Van’t Hoff

 Il n’est pas possible de corriger ces écarts il est donc important de noter la température.
Il n’est pas possible de corriger ces écarts il est donc important de noter la température.
- Effet sur la réponse de l’électrode :
Selon l’équation de Nernst la pente de la réponse dépend de la température :
E = E0 + 2.3RT / nF * log [H3O+]
L’effet de la température peut donc être compensé en corrigeant la valeur de pH par la pente effective de la droite.
 Il est donc important que la calibration soit faite à la température de mesure.
Il est donc important que la calibration soit faite à la température de mesure.
 Les électrodes ont des températures max d’utilisation !!!
Les électrodes ont des températures max d’utilisation !!!
Effet de la force ionique
Dans l’équation de Nernst plus que la concentration, c’est l’activité de l’ion (a) qu’il est nécessaire d’introduire dans le calcul du pH :
pH = - log a
H3O+
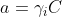
avec
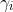
le coefficient d’activité
Loi de Debye Hückel : 
avec α le diamètre de l'ion hydraté (900pm pour H3O+)
I la force ionique 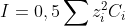
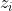
la charge des ions présents,
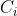
la concentration
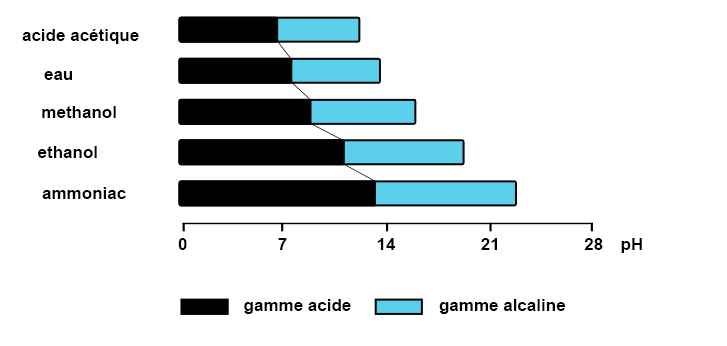
Mesure de pH en milieu non aqueux
En milieu organique ou des solutions non aqueuses (moins de 5 % d’eau) la définition classique du pH ne s’applique pas. La plage de pH conventionnelle de pH 0 à pH 14 basée sur la dissociation de l’eau n’est plus valable.
Exemple de plage de pH dans solvant
En solvant non aqueux : mesure d’une valeur relative du pH plutôt qu’une valeur absolue.
Pour faire des mesures quantitatives dans des solvants non aqueux :
établir une courbe d’étalonnage de l’électrode de pH en verre avec différents échantillons de composition connue et répondant aux conditions régnant dans les échantillons à mesurer.
 En présence de solvant , la membrane de l’électrode est dégradée : Réhydrater la couche de gel dans une solution riche en ions entre les expériences.
En présence de solvant , la membrane de l’électrode est dégradée : Réhydrater la couche de gel dans une solution riche en ions entre les expériences.
Colmatage du diaphragme de l’électrode : Origine
Présence de protéines, éléments riches en matière grasse.
Précipitation de l’électrolyte (KCl, AgCl) en présence.
KCl : précipite en présence de Hg 2+, Ag+, Pb 2+, ClO4-.
AgCl précipite en présence de Br-, Cn-, I- , et dérivés soufrés et cystine, cystéine.
Colmatage du diaphragme de l’électrode : Solution
Colmatage par le sulfure d’argent (Ag2S)
Nettoyer avec une solution à 8 % de thiourée dans 0.1 mol/L HCl.
Colmatage par le chlorure d’argent (AgCl)
Tremper l’électrode dans une solution concentrée d’ammoniaque.
Colmatage par des protéines
Immerger l’électrode pendant plusieurs heures dans une solution de pepsine/HCI (5 % pepsine dans 0.1 mol/L HCl).
Autres colmatages
Nettoyer l’électrode dans un bain à ultrasons avec de l’eau ou une solution de 0.1 mol/L HCl.
 Avant toute mesure s’assurer que l’étalonnage a été fait.
Avant toute mesure s’assurer que l’étalonnage a été fait.