La conductivité c'est quoi ?
La conductivité (notée σ) quantifie l'aptitude d'une solution à conduire le courant électrique (i.e. laisser se déplacer librement les charges électriques). Celle-ci est directement liée à la mobilité (notée ui) des ions i présents au sein de la solution, qui est la part de la conductivité indépendante de la concentration.
Pour un ion de forme sphérique, la mobilité suit la relation suivante selon la théorie de Stokes :
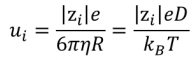
avec zi la charge de l'ion, e la charge élémentaire, η la viscosité, R le rayon de l'ion solvaté (rayon hydrodynamique), kB la constante de Boltzmann, D le coefficient de diffusion et T la température. La mobilité ui a pour unité m2.s-1.V-1.
On a alors :
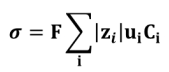
Avec F la constante de Faraday en C.mol-1 (charge d'une mole de charges élémentaires) et Ci la concentration en mol.m-3.
 Ci en mol.m-3 = 103Ci en mol.L-1
Ci en mol.m-3 = 103Ci en mol.L-1
Pour chaque ion, on définit de plus la conductivité molaire ionique λi (AiZi) par :
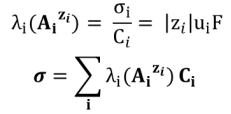
Pour un ion polychargé, on utilise plus souvent la conductivité molaire ionique par mole de charge (aussi appelée conductivité ionique équivalente ou spécifique 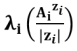 ) :
) :
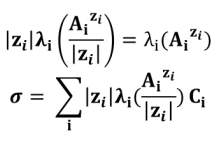
Lorsque C tend vers 0 (dillution infinie), on introduit alors la conductivité molaire ionique limite (λ°) : λ°i = limCi → 0 λi. Généralement en solution diluée on considère donc que :
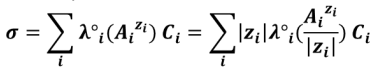
C'est ce qu'on appelle parfois la loi de Kohlrausch.