Des valeurs de conductivité ionique molaire à 25°C
Plus un ion est volumineux, plus sa mobilité est faible, et plus sa conductivité est faible. Il s'ensuit que les cations métalliques possèdent généralement des λ°i relativement faibles.
Attention à ne pas faire de conclusions hâtives car, en solution, les ions sont solvatés (présence d'une sphère de solvatation autour des ions) : plus l'ion est petit et chargé, plus la sphère de solvatation est grande. Ceci permet par exemple d'expliquer l'évolution des conductivité dans le cas des anions halogénures et les cations alcalins :
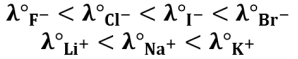
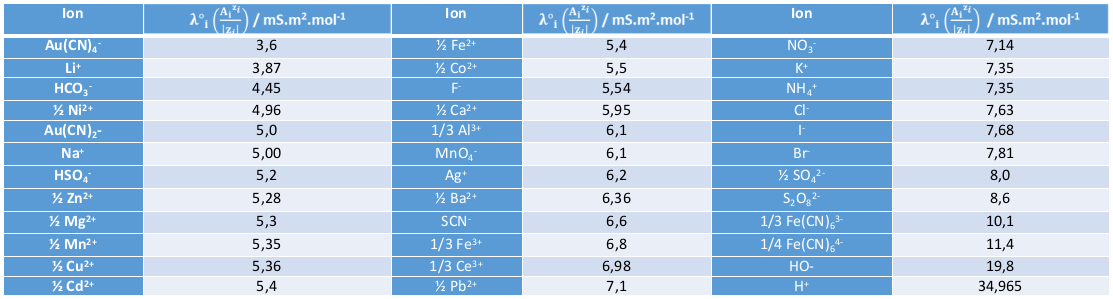
Les ions H+ et HO- possèdent les conductivités les plus élevées car leur mobilité est très différente de celle des autres ions. En effet ceux-ci, au contraire des autres ions, ne se déplacent pas en entier dans la solution pour porter leur charge : ils se déplacent de proche en proche via un réseau de liaisons hydrogènes : on parle de mécanisme de Grotthuss.