Analyse d’une eau de source
Potentiométrie
Dans cette section p correspond à –log : -log(a) s’écrit p(a) ou pa.
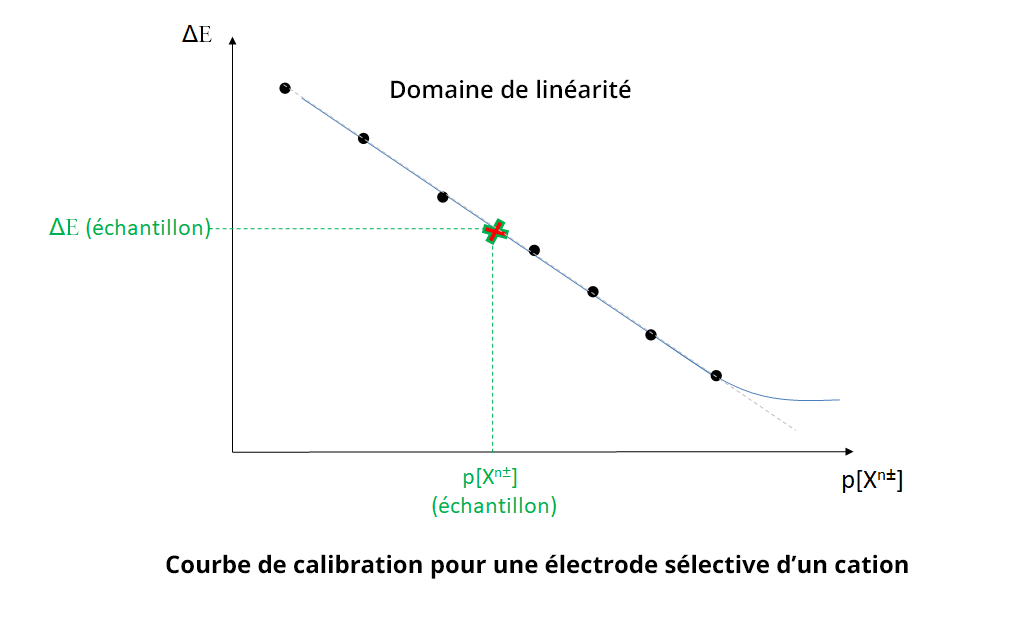
Pour déterminer la concentration en l’espèce d’intérêt, on réalise une droite d’étalonnage en utilisant des solutions étalons à différentes concentrations en espèce d’intérêt (méthode de la droite d’étalonnage). En pratique on trace ΔE = f (p[Xn±]) avec Xn± l’ion d’intérêt et ΔE la différence de potentiel (ddp) entre l’électrode sélective et une électrode de référence. La concentration de Xn± est déterminée en mesurant la ddp de l’échantillon, soit ΔE (échantillon), et en utilisant la droite d’étalonnage.
Comme dans le cas de l’électrode de verre (sélective des ions H+), une différence de potentiel (ddp) s’opère entre la membrane interne et la membrane externe de l’électrode sélective. Une électrode sélective à ion suit une loi dite de Nikolskii qui découle de cette différence des activités de l’ion considéré de chaque côté de la membrane :
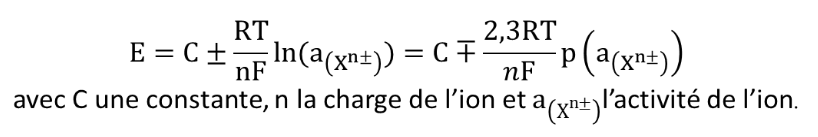
Dans tous les cas, les électrodes possèdent une limite de sensibilité qui correspond à la valeur seuil en dessous de laquelle il y a perte de linéarité. Il est important pour l’expérimentateur de se placer dans le domaine de linéarité de l’électrode. Celui-ci est généralement fourni par le constructeur mais peut être vérifié expérimentalement.
La force ionique est de plus maintenue constante par l’utilisation de solution de concentration fixée (0,1 – 1 mol/L) nommée ISA (Ionic Strength Adjustor).
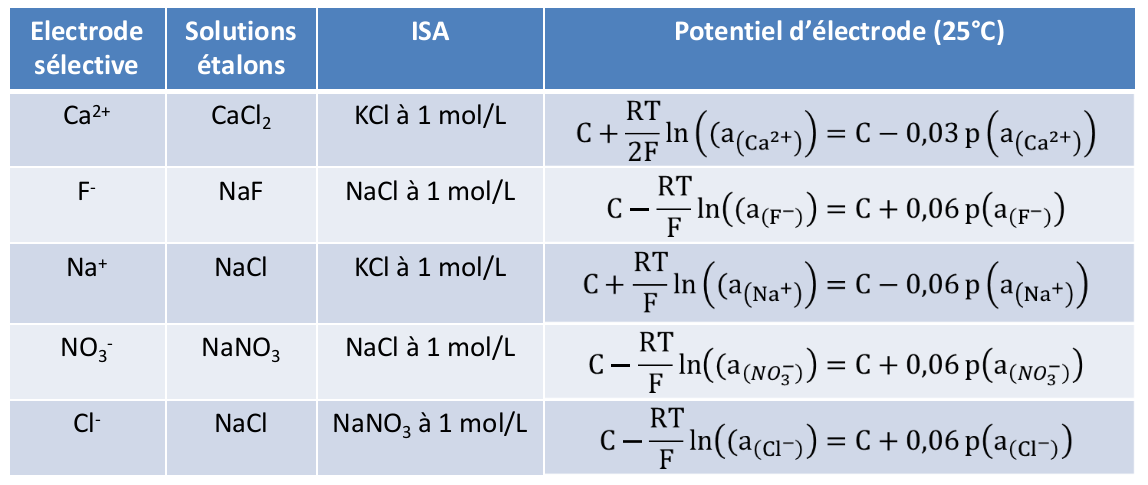
Dans la suite, nous assimilerons activité et concentration.